题目内容
5.25℃时,在10mL浓度均为0.1mol•L-1的盐酸和醋酸混合溶液中滴加0.1mol•L-1NaOH溶液,下列有关溶液中离子浓度关系正确的是( )| A. | 未加NaOH溶液时,c(H+)>c(CI-)═c(CH3COOH) | |
| B. | 加入10mLNaOH溶液时:c(CH3COO-)+c(OH-)═c(H+) | |
| C. | 加入NaOH溶液至PH=7时:c(Na+)═c(CI-) | |
| D. | 加入20mLNaOH溶液时:c(Na+)═c(CH3COO-)+c(CI-) |
分析 A.未加NaOH时,浓度均为0.1mol•L-1的HC1和CH3COOH混合溶液中,盐酸完全电离,醋酸部分电离;
B.加入l0mLNaOH时,酸全部反应,得到等浓度氯化钠和醋酸的混合物,根据溶液中的质子守恒来回答;
C.恰好反应时生成氯化钠和醋酸钠,醋酸根离子发生水解,溶液呈碱性,结合电荷守恒判断;
C.加入20mLNaOH时,得到的是等浓度的氯化钠、醋酸钠的混合物,根据电荷守恒来回答.
解答 解:A.未加NaOH时,浓度均为0.1mol•L-1的HC1和CH3COOH混合溶液中,盐酸完全电离,醋酸部分电离,c(H+)>c(Cl-)>c(CH3COOH),故A错误;
B.加入l0mLNaOH时,酸全部反应,得到等浓度的氯化钠和醋酸的混合物,氯化钠中钠离子和氯离子浓度相等,溶液中存在质子守恒:c(OH-)+c(CH3COO-)=c(H+),故B正确;
C.加入20mLNaOH时,得到的是等浓度的氯化钠、醋酸钠的混合物,醋酸根离子部分水解,溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒可知:c(Na+)>c(Cl-),故C错误;
D.加入20mLNaOH时,得到的是等浓度的氯化钠、醋酸钠的混合物,根据物料守恒可得:2c(CH3COOH)+2c(CH3COO-)=c(Na+),故D错误;
故选B.
点评 本题考查了酸碱混合的定性判断及溶液中离子浓度定性比较,题目难度中等,注意掌握酸碱混合后溶液酸碱性的判断方法,明确电荷守恒、物料守恒的含义,能够根据溶液中守恒关系判断各离子浓度大小,试题培养了学生的灵活应用能力.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
16.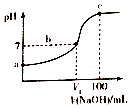 已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )
已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )
 已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )
已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图.下列说法正确的是( )| A. | a点溶液的pH=4 | |
| B. | b点溶液中存在:c(A-)>c(Na+)>c(H+)=c(OH-) | |
| C. | b点c(HA)/c(A-)=5 | |
| D. | c点c(A-)+c(H+)=c(Na+)+c(OH-) |
13.下列有关化学事实或现象解释正确的是( )
| A. | 将浓硝酸加入盛有铂、金的烧杯中,不反应,再加入一定量浓盐酸后,铂、金溶解,不能说明浓硝酸氧化性比浓盐酸强 | |
| B. | 石英玻璃、普通玻璃、陶瓷及水泥均属于硅酸盐产品 | |
| C. | 电解AlCl3水溶液,阴极周围出现白色胶状沉淀,说明Al(OH)3胶体粒子带正电荷 | |
| D. | 气体甲通入溶液乙,溶液乙的颜色褪去,说明气体甲具有漂白性 |
20.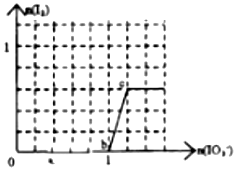 己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
 己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A. | 0~a间发生反应:3HSO3-+IO3-═3SO42-+I-+3H+ | |
| B. | a~b间共消耗NaHSO3的物质的量为1.8mol | |
| C. | b~c间反应:I2仅是氧化产物 | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的KIO3为1.1mol |
10.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径在短周期主族元素原子中最大,Y的核外电子数是W的2倍且同主族.下列说法不正确的是( )
| A. | 简单离子半径:X<W<Z | |
| B. | W、X、Y元素形成的盐溶于水,溶液一定呈中性 | |
| C. | W与X形成的常见化合物中阴、阳离子个数比均为1:2 | |
| D. | 1 mol Z 的单质与足量的NaOH溶液反应转移电子数1 NA |
17.下列4种有机物:
①
②
③
④
其中一氯取代物的同分异构体数目相同的是( )
①

②

③

④

其中一氯取代物的同分异构体数目相同的是( )
| A. | ①和② | B. | ②和③ | C. | ①和③ | D. | ②和④ |
14.七水硫酸镁(MgSO4•7H2O)为白色细小四角柱状结晶,无臭,味苦,在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣一硼镁泥可制取七水硫酸镁.硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、CaO、B2O3、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
表2两种盐的溶解度(单位为g/100g水)
硼镁泥制取七水硫酸镁的工艺流程如图
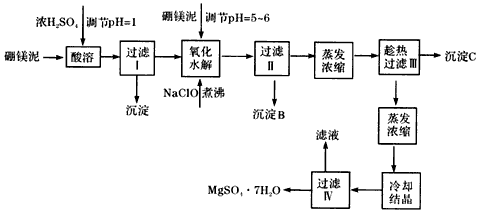
根据以上流程图并参考表格数据,试回答下列问题:
(1)在酸溶过程中,想加快酸溶速度,提出两种可行的措施加热,搅拌或将固体粉碎.
(2)沉淀A中除二氧化硅外,还含有硼酸(H3BO3),硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-
(3)经对沉淀B进行分析,发现其中含有二氧化锰,用离子方程式解释产生二氧化锰原因:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(4)加入硼镁泥调节pH=5~6目的是使溶液中的Al3+和Fe3+完全转化为沉淀而折出.
(5)得到的沉淀C的组成是CaSO4•2H2O或CaSO4(填化学式),过滤Ⅲ需趁热过滤,原因是趁热过滤有利于分离CaSO4和MgSO4并防止MgSO4在温度低时结晶析出
(6)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是取过滤Ⅱ后的溶液1~2ml丁试管中,加入少量KSCN溶液,如果溶液显红色,证明滤液中有Fe3+,否则无.
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | - |

根据以上流程图并参考表格数据,试回答下列问题:
(1)在酸溶过程中,想加快酸溶速度,提出两种可行的措施加热,搅拌或将固体粉碎.
(2)沉淀A中除二氧化硅外,还含有硼酸(H3BO3),硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-
(3)经对沉淀B进行分析,发现其中含有二氧化锰,用离子方程式解释产生二氧化锰原因:Mn2++ClO-+H2O=MnO2↓+2H++Cl-.
(4)加入硼镁泥调节pH=5~6目的是使溶液中的Al3+和Fe3+完全转化为沉淀而折出.
(5)得到的沉淀C的组成是CaSO4•2H2O或CaSO4(填化学式),过滤Ⅲ需趁热过滤,原因是趁热过滤有利于分离CaSO4和MgSO4并防止MgSO4在温度低时结晶析出
(6)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是取过滤Ⅱ后的溶液1~2ml丁试管中,加入少量KSCN溶液,如果溶液显红色,证明滤液中有Fe3+,否则无.
15.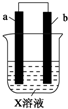 下列对如图所示装置实验现象的描述错误的是( )
下列对如图所示装置实验现象的描述错误的是( )
 下列对如图所示装置实验现象的描述错误的是( )
下列对如图所示装置实验现象的描述错误的是( ) | a电极 | b电极 | X溶液 | |
| ① | Cu | Zn | CuCl2 |
| ② | Zn | 石墨 | HCl |
| A. | 实验①中a极质量增加 | B. | 实验①中Cl-离子向正极移动 | ||
| C. | 实验②a极质量减少 | D. | 实验②中b极放出无色气体 |