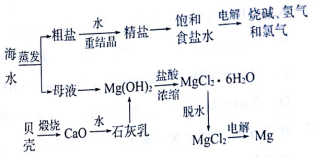
题目内容
10.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径在短周期主族元素原子中最大,Y的核外电子数是W的2倍且同主族.下列说法不正确的是( )| A. | 简单离子半径:X<W<Z | |
| B. | W、X、Y元素形成的盐溶于水,溶液一定呈中性 | |
| C. | W与X形成的常见化合物中阴、阳离子个数比均为1:2 | |
| D. | 1 mol Z 的单质与足量的NaOH溶液反应转移电子数1 NA |
分析 四种短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X是Na,Y的核外电子数是W的2倍且同主族,可知W为O、Y为S,Z只能为Cl元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:由以上分析可知W为O元素、X为Na元素、Y为S元素、Z为Cl元素.
A.X、W离子的电子层为2层,Z离子即氯离子电子层为3层,电子层多半径大,电子层结构相同时,序小半径反而大,则简单离子半径大小顺序是:X<W<Z,故A正确;
B.如生成Na2SO3,为强碱弱酸盐,溶液呈碱性,故B错误;
C.W与X形成的两种化合物为Na2O、Na2O2,晶体中阴、阳离子的个数比均为1:2,故C正确;
D.氯气和碱反应的方程式为:Cl2+2OH-=Cl-+ClO-+H2O,反应中Cl元素化合价由0价分别变为+1价、-1价,则1 mol Z 的单质与足量的NaOH溶液反应转移电子数1 NA,故D正确.
故选B.
点评 本题考查了原子结构与元素周期表的关系,为高频考点,题目难度中等,正确推断各元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.将0.2mol AgNO3、0.4mol Cu(NO3)2和0.6mol KCl溶于水配成100mL溶液,用惰性电极电解一段时间后,在一极上析出0.3mol Cu,此时,另一极上的气体体积(标准状况)为( )
| A. | 4.48 L | B. | 5.6 L | C. | 6.7 L | D. | 7.8 L |
18.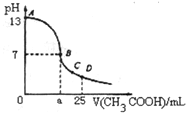 室温下在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,曲线如图所示,有关离子浓度关系比较正确的是( )
室温下在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,曲线如图所示,有关离子浓度关系比较正确的是( )
 室温下在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,曲线如图所示,有关离子浓度关系比较正确的是( )
室温下在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,曲线如图所示,有关离子浓度关系比较正确的是( )| A. | 在A、B间任意一点,溶液中一定都有c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| B. | 在B点:a>12.5,且有c(Na+)═c(CH3COO-)=c(OH-)═c(H+) | |
| C. | 在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 在D点:c(CH3COO-)=c(CH3COOH) |
5.25℃时,在10mL浓度均为0.1mol•L-1的盐酸和醋酸混合溶液中滴加0.1mol•L-1NaOH溶液,下列有关溶液中离子浓度关系正确的是( )
| A. | 未加NaOH溶液时,c(H+)>c(CI-)═c(CH3COOH) | |
| B. | 加入10mLNaOH溶液时:c(CH3COO-)+c(OH-)═c(H+) | |
| C. | 加入NaOH溶液至PH=7时:c(Na+)═c(CI-) | |
| D. | 加入20mLNaOH溶液时:c(Na+)═c(CH3COO-)+c(CI-) |
15.结合元素周期律,判断下列说法中正确的是( )
| A. | 核外电子层数越多的微粒半径一定较大 | |
| B. | 由5R-+RO-+6H+=3R+3H2O 判断,R元素可能是第ⅤA族元素 | |
| C. | 元素周期表对于生产和科研具有重要的指导意义,如半导体材料通常位于过渡元素区 | |
| D. | 既有非金属元素简单阴离子,又有非金属元素简单阳离子 |
2.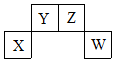 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸溶液反应,又能与强碱溶液反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸溶液反应,又能与强碱溶液反应.下列说法正确的是( )
 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸溶液反应,又能与强碱溶液反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸溶液反应,又能与强碱溶液反应.下列说法正确的是( )| A. | X的单质投入冷浓硫酸中剧烈反应 | |
| B. | 几种最低价气态氢化物稳定性:Z>W | |
| C. | W的氧化物对应的水化物一定是强酸 | |
| D. | Z的氧化物对环境有污染,Y的氧化物没有污染 |
20.化学与生产、生活、环境等社会实际密切相关.下列叙述正确的是( )
| A. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 | |
| B. | 制作航天服的聚脂纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| D. | 重金属离子能杀死H7N9禽流感病毒 |