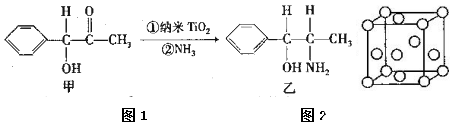
题目内容
15.(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知:①CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H=-283.0kJ•mol-1
②S(s)+O2(g)?SO2(g)△H=-296.0kJ•mol1
此反应的热化学方程式是2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270KJ•mol-1.
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体.已知:
CO(g)+NO2(g)?NO(g)+CO2(g)△H=-a kJ•mol-1(a>0)
2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-b kJ•mol-1(b>0)
若用标准状况下3.36L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为0.3mol,放出的热量为$\frac{3(2a+b)}{80}$kJ(用含有a和b的代数式表示).
(3)用CH4催化还原NOx也可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1①
CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H2=?②
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则△H2=-1160KJ/mol.
(4)某氮肥厂氨氮废水中的氮元素多以NH4+和NH3•H2O形式存在,该废水的处理流程中,NH4+在微生物作用的条件下经过两步反应被氧化成NO3-.两步反应的能量变化示意如图所示:
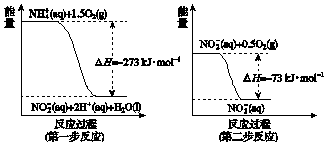
1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.
分析 (1)①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ•mol-1,②S(s)+O2(g)=SO2(g)△H=-296.0KJ•mol-1,将方程式①×2-②得热化学方程式;
(2)根据盖斯定律求出4CO(g)+2NO2(g)=N2(g)+4CO2(g)的反应热,反应中3.36LCO即0.15mol转移0.3mol电子,根据物质的量之比等于热量比求出放出的热量;
(3)已知①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=?②
将方程式①+②得2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=△H1+△H2,结合1molCH4还原NO2至N2的整个过程中放出的热量为867kJ计算;
(4)结合图象根据盖斯定律来计算反应的焓变,进而书写热化学方程式.
解答 解:(1)①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-296.0KJ•mol-1
将方程式①×2-②得2CO(g)+SO2(g)=S(s)+2CO2(g)△H=(-283.0KJ•mol-1)×2-(-296.0KJ•mol-1)=-270KJ•mol-1,
热化学反应方程式为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270KJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270KJ•mol-1;
(2)①CO(g)+NO2(g)=NO(g)+CO2(g)△H=-a KJ•mol-1(a>0)
②2CO(g)+2NO (g)=N2(g)+2CO2(g)△H=-b KJ•mol-1(b>0)
将方程式①×2+②得4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=(-a) KJ•mol-1×2+(-b KJ•mol-1)=-(2a+b)KJ•mol-1
所以其热化学反应方程式为:4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=-(2a+b)KJ•mol-1,
根据方程式知转移电子的物质的量=$\frac{3.36L}{22.4L/mol}$×2=0.3mol,放出的热量=$\frac{3.36L}{22.4L/mol}$×$\frac{(2a+b)kJ/mol}{4}$=$\frac{3(2a+b)}{80}$kJ,
故答案为:0.3;$\frac{3(2a+b)}{80}$;
(3)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=?②
将方程式①+②得2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=△H1+△H2,
根据方程式知,1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,所以△H2=-867KJ/mol×2-(-574KJ/mol)=-1160KJ/mol,
故答案为:-1160KJ/mol;
(4)第一步的热化学方程式为NH4+(aq)+1.5O2(g)═NO2-(aq)+2H+(aq)+H2O(l),△H=-273KJ/mol,第二步的热化学方程式为:NO2-(aq)+0.5O2(g)═NO3-(aq),△H=-73KJ/mol,根据盖斯定律则NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol,
故答案为:NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.
点评 本题综合考查了化学反应与能量变化,为高频考点,侧重考查学生的分析能力和计算能力,题目难度不大,注意把握图象中反应物的总能量与生成物的总能量的关系以及盖斯定律的应用.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
| A. | 分子中所有碳原子不可能共平面 | |
| B. | 能发生酯化反应、氧化反应、还原反应 | |
| C. | lmol该物质与H2完全加成,需消耗3mol H2 | |
| D. | 比该物质少一个O原子,属于芳香族化合物的同分异构体有3种 |
| A. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA | |
| B. | 1 molN2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 34g H2O2和H2S混合物中的氢原子数为2NA |
| 生成的盐 | 化学式 | 质量/g |
| A | ||
| B |
| A. | 未加NaOH溶液时,c(H+)>c(CI-)═c(CH3COOH) | |
| B. | 加入10mLNaOH溶液时:c(CH3COO-)+c(OH-)═c(H+) | |
| C. | 加入NaOH溶液至PH=7时:c(Na+)═c(CI-) | |
| D. | 加入20mLNaOH溶液时:c(Na+)═c(CH3COO-)+c(CI-) |
 写出同时满足下列条件的E的一种同分异构的结构简式:
写出同时满足下列条件的E的一种同分异构的结构简式:
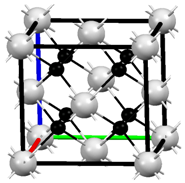 M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,该化合物有漂白性,能使品红溶液褪色,Z的基态原子4s和3d轨道半充满.请回答下列问题:
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,该化合物有漂白性,能使品红溶液褪色,Z的基态原子4s和3d轨道半充满.请回答下列问题: