题目内容
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、在标准状况下,11.2L氖气中含有NA个氖原子 |
| B、2 mol?L-1 的Na2SO4溶液中含有4NA个Na+ |
| C、NA个水分子的相对分子质量之和等于水的摩尔质量 |
| D、常温常压下,9克水所含的电子数为5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、氖气为单原子分子;
B、溶液体积不明确;
C、摩尔质量的单位是g/mol,而质量的单位是g;
D、求出水的物质的量,然后根据1mol水中含10mol电子来分析.
B、溶液体积不明确;
C、摩尔质量的单位是g/mol,而质量的单位是g;
D、求出水的物质的量,然后根据1mol水中含10mol电子来分析.
解答:
解:A、标况下,11.2L氖气的物质的量为0.5mol,但氖气为单原子分子,故0.5mol氖气中含0.5mol氖原子,故A错误;
B、溶液体积不明确,无法计算所含Na+的个数,故B错误;
C、摩尔质量的单位是g/mol,而质量的单位是g,故应为NA个水分子的质量在数值上等于水的摩尔质量,故C错误;
D、水的物质的量为0.5mol,而1mol水中含10mol电子,故0.5mol水含5mol电子,故D正确.
故选D.
B、溶液体积不明确,无法计算所含Na+的个数,故B错误;
C、摩尔质量的单位是g/mol,而质量的单位是g,故应为NA个水分子的质量在数值上等于水的摩尔质量,故C错误;
D、水的物质的量为0.5mol,而1mol水中含10mol电子,故0.5mol水含5mol电子,故D正确.
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
下列叙述正确的是( )
| A、在醋酸溶液的PH=a,将此溶液稀释1倍后,溶液的PH=b,则a>b |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的PH<7 |
| C、1.0×10-3盐酸的PH=3,1.0×10-8盐酸的PH=8 |
| D、若1mLPH=1的盐酸与100mLNaOH溶液混合后,溶液的PH=7则NaOH溶液的PH=11 |
下列物质的电子式书写正确的是 ( )
A、 |
B、 |
C、 |
D、 |
根据如图示判断下列叙述符合事实的是( )
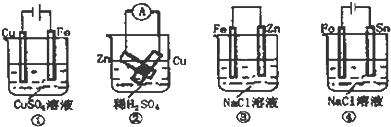

| A、按图①连接并放置一段时间后,Fe片表面会“镀”上一层铜 |
| B、按图②连接好导线后(Zn片与Cu片相接触),灵敏电流表会发生非常明显的偏转 |
| C、按图③连接并放置片刻,在Fe片附近加一滴KSCN溶液,溶液变为深红色 |
| D、按图④连接并放置一段时间后,在Sn片上有无色气泡聚集 |
设NA 为阿伏加德罗常数的值,下列叙述正确的是( )
| A、88.0g 干冰中含有的电子数为8.0NA |
| B、常温下,11.2 L 乙烯在氧气中完全燃烧转移的电子数为6.0NA |
| C、常温下1.0 L 0.1 mol?L-1NH4Cl 溶液中,NH4+和H+总数大于0.1NA |
| D、1.2g 金刚石中含有的碳碳键数为0.4 NA |
实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g 样品,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol?L-1 盐酸进行滴定,得到如下曲线.以下说法或操作正确的是( )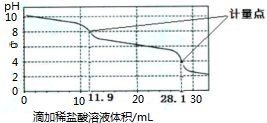

| A、上一个计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ |
| B、下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- |
| C、此样品n(NaHCO3)=(28.1-2×11.9)×10-3 mol |
| D、使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点 |
 某小组学生想研究不同物质对双氧水分解速率的影响,以生成气体量50mL为标准,设计了如下实验方案:
某小组学生想研究不同物质对双氧水分解速率的影响,以生成气体量50mL为标准,设计了如下实验方案: