题目内容
下列物质的电子式书写正确的是 ( )
A、 |
B、 |
C、 |
D、 |
考点:电子式
专题:
分析:A、水属于共价化合物,O原子外层有8个电子;
B、氮气中氮原子形成3对共用电子对,每个原子还剩余2个电子;
C、钠离子与氯离子通过离子键结合;
D、氯化氢属于共价化合物.
B、氮气中氮原子形成3对共用电子对,每个原子还剩余2个电子;
C、钠离子与氯离子通过离子键结合;
D、氯化氢属于共价化合物.
解答:
解:A、水属于共价化合物,O原子外层有8个电子,故A错误;
B、氮原子最外层有5个电子,要达到稳定结构得形成三对共用电子对,电子式为 ,故B正确;
,故B正确;
C、氯化钠为离子化合物,钠离子与氯离子通过离子键结合,电子式为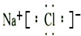 ,故C错误;
,故C错误;
D、氯化氢为共价化合物,氢原子与氯原子共用1对电子,电子式为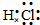 ,故D错误,故选B.
,故D错误,故选B.
B、氮原子最外层有5个电子,要达到稳定结构得形成三对共用电子对,电子式为
 ,故B正确;
,故B正确;C、氯化钠为离子化合物,钠离子与氯离子通过离子键结合,电子式为
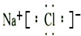 ,故C错误;
,故C错误;D、氯化氢为共价化合物,氢原子与氯原子共用1对电子,电子式为
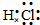 ,故D错误,故选B.
,故D错误,故选B.
点评:本题考查电子式的正误判断,题目难度不大,该题是基础性试题的考查,也是高考中的常见题型,主要是考查学生对常见物质电子式的熟悉了解程度,明确物质中化学键的类型是解题的关键.

练习册系列答案
相关题目
25℃在25ml、C1mol?L-1,的一元弱酸(HA)中,加入v2mL、0.1mol/L的一元强碱 (BOH).下列有关判断一定正确的是( )
| A、当25Cl=0.1V2时;c(A-)>c(B-) |
| B、当PH>7时,;c(A-)>c(OH-) |
| C、当pH=7,且V2=25 时,C1>0.1 |
| D、当PH<7 时,c(B+)>c(A-) |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol ②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)?△H=-192.9kJ/mol根据上述反应,下列说法正确的是( )
A、 反应①中的能量变化如图所示 |
| B、可推知2H2(g)+O2(g)=2H2O(g)?△H=-483.8 kJ/mol |
| C、1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D、CH3OH转变成H2的过程一定要吸收能量 |
下列叙述错误的是( )
| A、标准状况下,5LCH4与5LNH3的原子个数之比为5:4 |
| B、常温常压下,11.2LO3中所含氧原子个数大于1.5NA |
| C、同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的质量 |
| D、同温、同压下,CO和CO2的密度比为7:11 |
已知反应①:CO(g)+CuO(s)?CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)?Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是( )
A、反应①的平衡常数K1=
| ||
B、反应③的平衡常数K=
| ||
| C、对于反应③,恒容时,温度升高,H2浓度减小,则该反应为吸热反应 | ||
| D、对于反应③,恒温恒容下,增大压强,H2浓度一定增大 |
化学知识在生产和生活中有着重要的应用,下列说法中不正确的是( )
| A、鼓励使用太阳能、风能等清洁能源能减少PM2.5的污染 |
| B、与铜质水龙头连接处的钢质水管易发生腐蚀 |
| C、发酵粉中含有较多的NaHCO3,能使焙制出的糕点疏松多孔 |
| D、金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火 |
下列说法正确的是( )
| A、玻璃钢是一种复合材料,由基体和增强体组成,基体起骨架作用 |
| B、SO2溶于水,其水溶液能导电,说明SO2是电解质 |
| C、食醋、纯碱、食盐分别属于酸、碱、盐 |
| D、生铁、不锈钢、青铜都属于合金 |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、在标准状况下,11.2L氖气中含有NA个氖原子 |
| B、2 mol?L-1 的Na2SO4溶液中含有4NA个Na+ |
| C、NA个水分子的相对分子质量之和等于水的摩尔质量 |
| D、常温常压下,9克水所含的电子数为5NA |
 滴定法是一种用于测定的非常重要的方法.
滴定法是一种用于测定的非常重要的方法.