题目内容
4.呋喃酚是生产呋喃丹、好安威等农药的主要中间体,是高附加值的精细化工产品.一种以邻氯苯酚(A)为主要原料合成呋喃酚(F)的流程如图: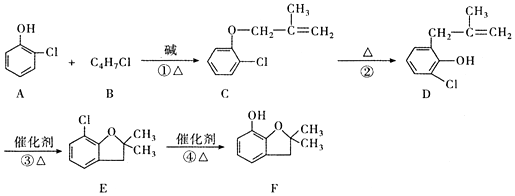
回答下列问题:
(1)A 物质核磁共振氢谱共有5个峰,④的反应类型是取代反应,C和D中含有的相同官能团的名称是氯原子、碳碳双键.
(2)下列试剂中,能和D反应的有AB(填标号).
A.溴水 B.酸性K2Cr2O7溶液 C.FeC12溶液 D.小苏打溶液
(3)写出反应①的化学方程式是
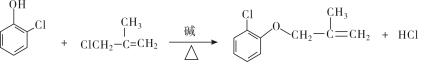 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).(4)有机物B可由异丁烷经三步反应合成:异丁烷$→_{1:1}^{Cl_{2}光照}$X$\stackrel{条件a}{→}$Y$→_{500℃}^{Cl_{2}}$有机物B,条件a为NaOH的乙醇溶液、加热,Y生成B的化学方程式为CH2=C(CH3)2+Cl2$\stackrel{500℃}{→}$CH2=C(CH3)CH2Cl+HCl.
分析 由合成流程可知,A与B发生取代反应生成C,C、D的分子式相同、结构不同,D发生加成反应生成E,E发生水解反应生成F,
(1)A中含5种H,④中-Cl转化为-OH,C和D均含碳碳双键、-Cl;
(2)D含碳碳双键、-OH、-Cl,结合烯烃、酚的性质来分析;
(3)反应①为取代反应;
(4)异丁烷$→_{1:1}^{Cl_{2}光照}$X$\stackrel{条件a}{→}$Y$→_{500℃}^{Cl_{2}}$有机物B,可知X为C(CH3)2ClCH3,Y为CH2=C(CH3)2,以此来解答.
解答 解:(1)A 含5种H,A物质核磁共振氢谱共有5个峰,④中-Cl转化为-OH,为 取代反应; C和D均含官能团碳碳双键、氯原子,
故答案为:5;取代反应;氯原子、碳碳双键;
(2)A.D含碳碳双键,与溴水发生加成反应,故A选;
B.含酚-OH,与酸性K2Cr2O7溶液发生氧化反应,故B选;
C.FeC12溶液与不反应,故C不选;
D.不含-COOH,与小苏打不反应,故D不选;
故答案为:A B;
(3)反应①的化学方程式是 ,
,
故答案为: ;
;
(4)异丁烷$→_{1:1}^{Cl_{2}光照}$X$\stackrel{条件a}{→}$Y$→_{500℃}^{Cl_{2}}$有机物B,可知X为C(CH3)2ClCH3,Y为CH2=C(CH3)2,X→Y发生卤代烃的消去反应,试剂a为NaOH的乙醇溶液、加热;Y生成B的化学方程式为CH2=C(CH3)2+Cl2$\stackrel{500℃}{→}$CH2=C(CH3)CH2Cl+HCl,
故答案为:NaOH的乙醇溶液、加热;CH2=C(CH3)2+Cl2$\stackrel{500℃}{→}$CH2=C(CH3)CH2Cl+HCl.
点评 本题考查有机物的合成,为高频考点,把握官能团的变化、碳链变化、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度中等.

| A. | 铜 | B. | 生理盐水 | C. | 氢氧化钠 | D. | 乙醇 |
| A. | 氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3•H2O═Al(OH)3↓+3NH4 | |
| B. | 存在于污水中的细菌,常用投加明矾等电解质的方法进行处理 | |
| C. | 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 | |
| D. | 依据铝热反应原理,能发生反应2Al+3MgO═3Mg+Al2O3 |
| A. | 由 Al、Cu、稀 H2SO4 组成原电池,放电时 SO42-向 Al 电极移动 | |
| B. | 由 Mg、Al、NaOH 溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由 Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出 1 mol Ag时,消耗铜电极32 g | |
| D. | 由 Fe、Cu、FeCl3 溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
| A. | 负极反应Al-3e-=Al3+ | B. | H2O2在石墨电极上发生氧化反应 | ||
| C. | 石墨电极附近溶液的pH增大 | D. | 海水中的 OH ? 向正极移动 |
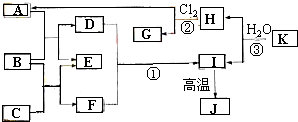 图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).
图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出). .
.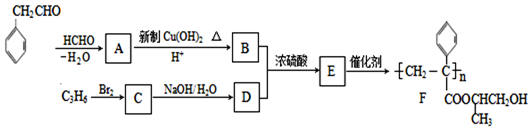
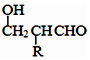 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$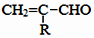
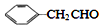 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比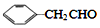 大14的,则符合下列条件的G的同分异构体有9种.
大14的,则符合下列条件的G的同分异构体有9种.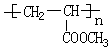 的合成路线
的合成路线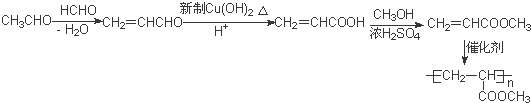 .
.