题目内容
9.下列有关原电池的说法中不正确的是( )| A. | 由 Al、Cu、稀 H2SO4 组成原电池,放电时 SO42-向 Al 电极移动 | |
| B. | 由 Mg、Al、NaOH 溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由 Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出 1 mol Ag时,消耗铜电极32 g | |
| D. | 由 Fe、Cu、FeCl3 溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
分析 A.Al失去电子作负极,原电池中阴离子向负极移动;
B.Al失去电子生成偏铝酸根离子;
C.Cu失去电子,则Cu为负极,用石墨电极来电解硝酸银溶液,结合电子守恒可知Cu~2e-~2Ag;
D.Fe比Cu活泼,Fe失去电子作负极.
解答 解:A.Al失去电子作负极,原电池中阴离子向负极移动,则放电时 SO42-向 Al 电极移动,故A正确;
B.Al失去电子生成偏铝酸根离子,则负极反应式为Al-3e-+4OH-=AlO2-+2H2O,故B正确;
C.Cu失去电子,则Cu为负极,用石墨电极来电解硝酸银溶液,结合电子守恒可知Cu~2e-~2Ag,当析出 1 mol Ag时,消耗铜电极为0.5mol×64g/mol=32 g,故C正确;
D.Fe比Cu活泼,Fe失去电子作负极,则负极反应为Fe-2e-=Fe2+,故D错误;
故选D.
点评 本题考查原电池及工作原理,为高频考点,把握电极、电极反应、离子移动为解答的关键,侧重分析与应用能力的考查,注意原电池的工作原理,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
19.已知氢氟酸在水溶液中建立如下电离平衡:HF?H++F-,如只改变一个条件一定可以使c(HF)/c(H+)减小的是( )
| A. | 通HCl(g) | B. | 加入少量KF(s) | C. | 加入少NaOH(s) | D. | 通入少量HF(g) |
20.化学 与生产、生活息息相关,下列叙述错误的是( )
| A. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| B. | 铁表面镀锌可增强其抗腐蚀性 | |
| C. | 用聚乙烯塑料代替聚乳酸塑料可减少白色污染 | |
| D. | 制饭勺、饭盒、高压锅等的不锈钢是合金 |
17.分子式为C6H10O4,且能与NaHCO3反应的只含一种官能团的有机物共有(不含立体异构)( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
14.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将氨水滴加到饱和的FeCl3溶液中并加热 |
| B | 由AlCl3溶液制备无水AlCl3 | 将AlCl3溶液加热蒸干 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D | 除去HBr中混有的Br2蒸汽 | 将混合气体通入盛有CCl4的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
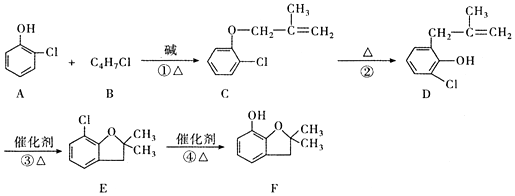
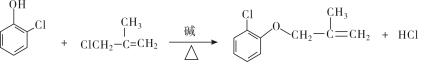 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).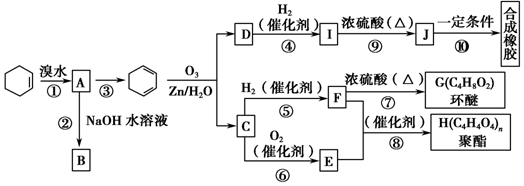
 .
.