题目内容
19.聚合物F的合成路线图如下:
已知:HCHO+RCH2CHO→
 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$
请据此回答:
(1)A中含氧官能团名称是醛基,C的系统命名为1,2-二溴丙烷.
(2)检验B中所含官能团所用的试剂有NaHCO3溶液(或Na2CO3)、溴水(或Br2的CCl4溶液);E→F的反应类型是加聚反应.
(3)C生成D的反应化学方程式为CH3CHBrCH2Br+2NaOH→CH3CH(OH)CH2OH+2NaBr,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为CH3C≡CH(同一个碳原子上连两个碳碳双键的除外).
(4)G物质与
 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比 大14的,则符合下列条件的G的同分异构体有9种.
大14的,则符合下列条件的G的同分异构体有9种.①分子中含有苯环,且苯环上有两个取代基
②遇氯化铁溶液变紫色
③能与溴水发生加成反应
(5)参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备
 的合成路线
的合成路线 .
.
分析 根据题中各物质转化关系,结合题中信息,苯乙醛与甲醛发生羟醛缩合并失水生成A,A的结构简式为 ;A与新制氢氧化铜悬浊液反应,醛基变为羧基,则B的结构简式为
;A与新制氢氧化铜悬浊液反应,醛基变为羧基,则B的结构简式为 ;据F的结构简式可知,C3H6为丙烯,C为CH3CHBrCH2Br,其水解生成D,D为CH3CH(OH)CH2OH;B与D在浓硫酸作用下发生酯化反应应,生成的E为
;据F的结构简式可知,C3H6为丙烯,C为CH3CHBrCH2Br,其水解生成D,D为CH3CH(OH)CH2OH;B与D在浓硫酸作用下发生酯化反应应,生成的E为 ,E发生加聚反应生成F,据此分析解答.
,E发生加聚反应生成F,据此分析解答.
解答 解:根据题中各物质转化关系,结合题中信息,苯乙醛与甲醛发生羟醛缩合并失水生成A,A的结构简式为 ;A与新制氢氧化铜悬浊液反应,醛基变为羧基,则B的结构简式为
;A与新制氢氧化铜悬浊液反应,醛基变为羧基,则B的结构简式为 ;据F的结构简式可知,C3H6为丙烯,C为CH3CHBrCH2Br,其水解生成D,D为CH3CH(OH)CH2OH;B与D在浓硫酸作用下发生酯化反应应,生成的E为
;据F的结构简式可知,C3H6为丙烯,C为CH3CHBrCH2Br,其水解生成D,D为CH3CH(OH)CH2OH;B与D在浓硫酸作用下发生酯化反应应,生成的E为 ,E发生加聚反应生成F,
,E发生加聚反应生成F,
(1)A为 ,其所含氧官能团为醛基;据F的结构简式可知,C3H6为丙烯,其与溴放出加成反应生成的C为1,2-二溴丙烷,
,其所含氧官能团为醛基;据F的结构简式可知,C3H6为丙烯,其与溴放出加成反应生成的C为1,2-二溴丙烷,
故答案为:醛基;1,2-二溴丙烷;
(2)B为 ,B中含有的官能团为羧基和碳碳双键,可用碳酸氢钠溶液检验羧基、用溴水检验碳碳双键;E为
,B中含有的官能团为羧基和碳碳双键,可用碳酸氢钠溶液检验羧基、用溴水检验碳碳双键;E为 ,E通过加聚反应生成F,
,E通过加聚反应生成F,
故答案为:NaHCO3溶液(或Na2CO3)、溴水(或Br2的CCl4溶液);加聚反应;
(3)C为1,2-二溴丙烷,其水解生成D,D为1,2-二羟基丙醇,反应的化学方程式为:CH3CHBrCH2Br+2NaOH→CH3CH(OH)CH2OH+2NaBr;
C与氢氧化钠的醇溶液发生消去反应生成CH3C≡CH,
故答案为:CH3CHBrCH2Br+2NaOH→CH3CH(OH)CH2OH+2NaBr;CH3C≡CH;
CH3CHBrCH2Br+2NaOH→CH3CH(OH)CH2OH+2NaBr;CH3C≡CH(写成CH2=C=CH2也给分);
(4)G物质与 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比 大14,则G比
大14,则G比 多1个CH2原子团;且满足:①分子中含有苯环,且苯环上有两个取代基;②遇氯化铁溶液变紫色,则有机物分子中含有酚羟基;③能与溴水发生加成反应,说明其分子中含有碳碳双键;
多1个CH2原子团;且满足:①分子中含有苯环,且苯环上有两个取代基;②遇氯化铁溶液变紫色,则有机物分子中含有酚羟基;③能与溴水发生加成反应,说明其分子中含有碳碳双键;
根据分析可知,满足体积的有机物分子中含有苯环,苯环上两个取代基分别为-OH、-C3H5,-C3H5可能为①-CH=CHCH3、②-CH2CH=CH2、③-C(CH3)=CH2,酚羟基与①②③分别侧重邻、间、对3种结构,所以满足条件的有机物总共有:3×3=9种,
故答案为:9;
(5)据已知反应可知,甲醛与乙醛发生羟醛缩合反应后失水生成CH2=CHCHO,然后用弱氧化剂新制氢氧化铜将醛基氧化为羧基,再与甲醇发生酯化反应生成CH2=CHCOOCH3,其发生加聚反应可得 ,
,
则合成路线为: ,
,
故答案为: .
.
点评 本题考查有机合成,题目难度中等,正确推断各物质名称为解答关键,注意熟练掌握常见有机物组成、结构与性质,试题培养了学生的分析、理解能力及逻辑推理能力.

 通城学典默写能手系列答案
通城学典默写能手系列答案 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.(1)如图是用海水制取少量蒸馏水的简易装置,其原理与课本中的实验原理完全相同.装置中使用了较长的玻璃管,其作用是导气兼冷凝,烧杯中还应盛装的物质是冰水.
(2)海带中含有丰富的碘,海带提碘可将海带灼烧、溶解、煮沸、过滤得含I-的滤液,滤液经酸化、氧化得含单质碘的溶液.回答下列问题:
①海带灼烧时用来盛装海带的仪器是坩埚(填仪器名称)
②已知KMnO4、H2O2、Cl2等均可与I-反应生成I2,且KMnO4、H2O2、Cl2对应的生成物分别为Mn2+、H2O、Cl-.从绿色化学的角度看I-转化成I2,最好选H2O2 (上述三种中选择)
(3)海水晒盐得到的盐含有较多的杂质.某学习小组欲设计实验提纯粗盐.
①若只除去其中的不溶性杂质,应经过的实验步骤是溶解、过滤、蒸发.
②若要进一步除去上述粗盐中的可溶性杂质,应选择合理的除杂试剂.请填写表:
| 杂质 | CaCl2 | MgCl2 | Na2SO4 |
| 除杂试剂 |
④上述除杂试剂加入的先后顺序应满足的一般条件是Na2CO3溶液应加在BaCl2溶液之后
⑤按顺序加入上述除杂试剂过滤后,还应加入适量稀HCl,其目的是除去过量除杂试剂中的OH-和CO32-,,判断加入稀HCl适量的方法可以是向滤液中逐滴滴加稀HCl,调节溶液pH=7.
| A. | 2H++2e-=H2↑ | B. | Fe-3e-=Fe3+ | ||
| C. | Fe-2e-=Fe2+ | D. | O2+2H2O+4e-=4OH- |
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为 283 kJ | |
| B. | 反应①正反应活化能与逆反应活化能之差为+566 kJ/mol | |
| C. | 反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 6.02×1023 |
| X | Y | Z |
| W | ||
| T |
| A. | W的氧化物对应水化物是强酸 | |
| B. | Z、W元素在自然界中均不能以游离态存在 | |
| C. | X、Y、Z元素的离子半径及它们的气态氢化物的热稳定性均依次递增 | |
| D. | 由元素周期律,可以推测T元素的单质具有半导体特性,T2Y3具有氧化性和还原性 |
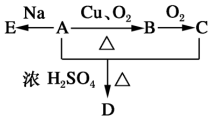 化合物A(C4H10O)是一种有机溶剂,A可以发生如图变化:
化合物A(C4H10O)是一种有机溶剂,A可以发生如图变化:
 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).