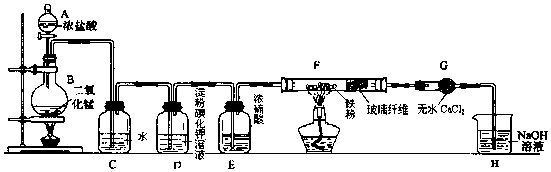
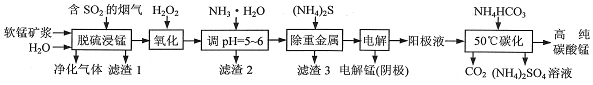
题目内容
13.按要求回答下列问题:(1)同温同压下,已知O2的密度为ρg/L,则CO2的密度为$\frac{11}{8}$ρg/L.
(2)现有下列三种气体:①32g CH4;②约含有6.02×1023个HC1分子的氯化氢气体;③标准状况下33.6LO2.请按物理量由小到大的顺序排列:
a.质量①<②<③(填序号,下同);
b.分子数目②<③<①
c.相同状况下气体的体积②<③<①.
分析 (1)同温同压下,气体的Vm相等,由ρ=$\frac{m}{V}$=$\frac{nM}{n{V}_{m}}$=$\frac{M}{{V}_{m}}$可知,气体的密度之比等于摩尔质量之比;
(2)结合各物质相关量根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$进行计算.
解答 解:(1)由ρ=$\frac{m}{V}$=$\frac{nM}{n{V}_{m}}$=$\frac{M}{{V}_{m}}$可知,相同条件下气体的密度与摩尔质量成正比,则:$\frac{44g/mol}{32g/mol}$=$\frac{ρ(C{O}_{2})}{ρg/L}$,解得CO2的密度为:ρ(CO2)=$\frac{11}{8}$ρg/L,
故答案为:$\frac{11}{8}$ρg/L;
(2)①32g CH4的物质的量为:$\frac{32g}{16g/mol}$=2mol;
②约含有6.02×1023个HC1分子的物质的量为:$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1mol,其质量为:36.5g/mol×1mol=36.5g;
③标准状况下33.6LO2的物质的量为:$\frac{33.6L}{22.4L/mol}$=1.5mol,其质量为:44g/mol×1.5mol=66g;
a.根据分析可知,三种物质的质量大小为:①<②<③,
故答案为:①<②<③;
b.根据n=nNA可知,气体分子数与物质的量成正比,气体的物质的量大小为:②<③<①,则三种气体含有分子数大小为:②<③<①,
故答案为:②<③<①;
c.根据n=nVm可知,相同条件下气体的体积与物质的量成正比,气体的物质的量大小为:②<③<①,则三种气体的体积大小为:②<③<①,
故答案为:②<③<①.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与其它物理量之间的关系即可解答,试题有利于提高学生的化学计算能力.

| X | Y | Z |
| W | ||
| T |
| A. | W的氧化物对应水化物是强酸 | |
| B. | Z、W元素在自然界中均不能以游离态存在 | |
| C. | X、Y、Z元素的离子半径及它们的气态氢化物的热稳定性均依次递增 | |
| D. | 由元素周期律,可以推测T元素的单质具有半导体特性,T2Y3具有氧化性和还原性 |
| A. | 1mol/L | B. | 2 mol/L | C. | 0.5 mol/L | D. | 1.5 mol/L |
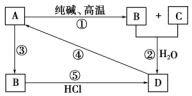 已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题.
已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题.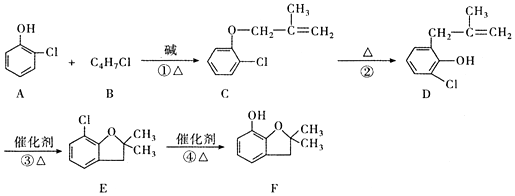
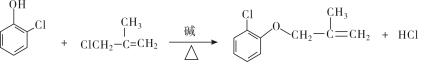 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).
 .
.