题目内容
15.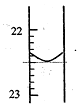 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:Ⅰ.配制100mL 0.10mol/L NaOH标准溶液.
Ⅱ.取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如表.
| 实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积 (mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.00 | |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
(2)根据上述数据,可计算出该盐酸的浓度为0.09275mol/L.
(3)在上述实验中,下列操作会造成测定结果偏高的有ABE
A.滴定终点时俯视读数
B.酸式滴定管使用前,水洗后未用待测稀盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液,定容时仰视
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
分析 (1)由图可知,22~23有10个刻度,滴定管的感量为0.01mL;
(2)实验1中消耗NaOH为22.50mL,误差较大,舍弃;则消耗NaOH为$\frac{18.56mL+18.54mL}{2}$=18.55mL,结合n(NaOH)=n(HCl)计算;
(3)由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,不当操作使V(NaOH)偏大,则会造成测定结果偏高.
解答 解:(1)由图可知,22~23有10个刻度,滴定管的感量为0.01mL,则则第一次实验滴定完用去NaOH溶液的体积记录为22.50mL,故答案为:22.50;
(2)实验1中消耗NaOH为22.50-0.10=22.40mL,误差较大,舍弃;则消耗NaOH为$\frac{18.56mL+18.54mL}{2}$=18.55mL,则0.01855L×0.1mol/L=c(盐酸)×0.02L,解得c(盐酸)=0.09275mol/L,故答案为:0.09275mol/L;
(3)A.滴定终点时俯视读数,V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏高,故A选;
B.酸式滴定管使用前,水洗后未用待测稀盐酸溶液润洗,消耗V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏高,故B选;
C.锥形瓶水洗后未干燥,对实验无影响,故C不选;
D.配制NaOH标准溶液,定容时仰视,c(NaOH)偏大,消耗的V(NaOH)偏小,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏低,故C不选;
E.碱式滴定管尖嘴部分有气泡,滴定后消失,V(NaOH)偏大,由c(盐酸)=$\frac{c(NaOH)V(NaOH)}{V(盐酸)}$可知,会造成测定结果偏高,故E选;
故答案为:ABE.
点评 本题考查中和滴定实验,为高频考点,把握仪器的使用、滴定原理、数据处理及误差分析为解答的关键,侧重分析与实验能力的考查,注意结合计算式分析误差,题目难度不大.

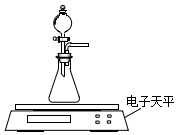 碳酸钙、盐酸是中学化学实验中的常用试剂.
碳酸钙、盐酸是中学化学实验中的常用试剂.(1)甲同学拟测定CaCO3固体与过量0.1mol•L-1 HCl的反应速率.
①该反应的离子方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
②设计实验方案:通过测量生成二氧化碳的体积和反应时间或消耗碳酸钙固体的质量和反应时间计算反应速率
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.电子天平限选试剂与用品:0.1mol•L-1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定生成等质量二氧化碳所需时间
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①-⑥所代表的必要数据或物理量
| 物理量 实验序号 | V(0.1mol•L-1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
| 实验1 | a | b | 0 | c | d | |
| 实验2 | ① | 0 | ③ | c | d | |
| 实验3 | c | ② | 0 | ④ | d |
| A. |  CH3+Cl2$\stackrel{光照}{→}$ CH3+Cl2$\stackrel{光照}{→}$ CH2Cl+HCl CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$ 2CH3CHO+2H2O | |
| C. | ClCH2═CH2+NaOH$→_{△}^{水}$ HOCH2CH═CH2+NaCl | |
| D. |  +HONO2$→_{△}^{浓硫酸}$ +HONO2$→_{△}^{浓硫酸}$ NO2+H2O NO2+H2O |
 .
. .
. ;
; ②④ C.⑤②③①④ D.④②①③⑤
②④ C.⑤②③①④ D.④②①③⑤