��Ŀ����
10��l��6-�����ᣨG���Ǻϳ���������Ҫԭ��֮һ�����ú�����̼ԭ�ӵ��л������������Ʊ�����ͼΪAͨ��������Ӧ�Ʊ�G�ķ�Ӧ���̣����ܵķ�Ӧ�м�����ΪB��C��D��E��F����
��1��������A�к�̼87.8%������Ϊ�⣬A�Ļ�ѧ����Ϊ����ϩ��
��2��C��D �ķ�Ӧ����Ϊ������Ӧ��
��3��F�Ľṹ��ʽΪ
 ��
����4��B��C��D�����м������У��˴Ź������׳���������D�����ٵ���B��
��5��������һ���л��߷��ӻ������G�ϳ������Ļ�ѧ����ʽΪ
 ��
����6����Aͨ��������Ӧ�Ʊ�1��3-������ϩ�ĺϳ�·��Ϊ
 $\stackrel{Br_{2}/CCl_{4}}{��}$
$\stackrel{Br_{2}/CCl_{4}}{��}$ $��_{��}^{NaOH/C_{2}H_{5}OH}$
$��_{��}^{NaOH/C_{2}H_{5}OH}$ ��
��
���� ������A�к�̼87.8%������Ϊ�⣬��̼��ԭ�Ӹ�����Ϊ��$\frac{0.878}{12}$��$\frac{1-0.878}{1}$=6��10����֪A��������̼ԭ�ӣ���A�ķ���ʽ��C6H10��A�ṹ��ʽΪ ��˫��ˮ��Ӧ����
��˫��ˮ��Ӧ���� ��
�� ��ˮ�����ӳɷ�Ӧ����
��ˮ�����ӳɷ�Ӧ���� ��
�� ����������Ӧ����
����������Ӧ���� ��
�� �ٷ���������Ӧ����
�ٷ���������Ӧ���� ��
�� �ٷ���������Ӧ����F��FΪ��
�ٷ���������Ӧ����F��FΪ��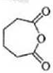 ��
�� �ٷ���������Ӧ����
�ٷ���������Ӧ���� ��
�� ��
�� �������۷�Ӧ������������ѧʽΪ��
�������۷�Ӧ������������ѧʽΪ�� ��
��
��6��A���巢���ӳɷ�Ӧ���� ��
�� ������ȥ��Ӧ����
������ȥ��Ӧ���� ��
��
��� �⣺������A�к�̼87.8%������Ϊ�⣬��̼��ԭ�Ӹ�����Ϊ��$\frac{0.878}{12}$��$\frac{1-0.878}{1}$=6��10����֪A��������̼ԭ�ӣ���A�ķ���ʽ��C6H10��A�ṹ��ʽΪ ��˫��ˮ��Ӧ����
��˫��ˮ��Ӧ���� ��
�� ��ˮ�����ӳɷ�Ӧ����
��ˮ�����ӳɷ�Ӧ���� ��
�� ����������Ӧ����
����������Ӧ���� ��
�� �ٷ���������Ӧ����
�ٷ���������Ӧ���� ��
�� �ٷ���������Ӧ����F��FΪ��
�ٷ���������Ӧ����F��FΪ�� ��
�� �ٷ���������Ӧ����
�ٷ���������Ӧ���� ��
�� ��
�� �������۷�Ӧ������������ѧʽΪ��
�������۷�Ӧ������������ѧʽΪ�� ��
��
��1��A�ṹ��ʽΪ ������Ϊ����ϩ���ʴ�Ϊ������ϩ��
������Ϊ����ϩ���ʴ�Ϊ������ϩ��
��2��C����������Ӧ����D���ʴ�Ϊ��������Ӧ��
��3��ͨ�����Ϸ���֪��FΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��4���˴Ź�������������ԭ��������ͬ����ԭ������Խ����˴Ź���������Խ�࣬B�ĺ˴Ź������׳���Ϊ3��C�ĺ˴Ź������׳���Ϊ4��D�ĺ˴Ź������׳���Ϊ6��E�ĺ˴Ź������׳���Ϊ6��F�ĺ˴Ź������׳���Ϊ2������BCD�к˴Ź���������������D�����ٵ���B��
�ʴ�Ϊ��D��B��
��5��G�ϳ������ķ���ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��6��A���巢���ӳɷ�Ӧ���� ��
�� ������ȥ��Ӧ����
������ȥ��Ӧ���� ��������ϳ�·��Ϊ
��������ϳ�·��Ϊ $\stackrel{Br_{2}/CCl_{4}}{��}$
$\stackrel{Br_{2}/CCl_{4}}{��}$ $��_{��}^{NaOH/C_{2}H_{5}OH}$
$��_{��}^{NaOH/C_{2}H_{5}OH}$ ��
��
�ʴ�Ϊ�� $\stackrel{Br_{2}/CCl_{4}}{��}$
$\stackrel{Br_{2}/CCl_{4}}{��}$ $��_{��}^{NaOH/C_{2}H_{5}OH}$
$��_{��}^{NaOH/C_{2}H_{5}OH}$ ��
��
���� ���⿼���л���ĺϳɣ����������ѧ���ķ������ƶϡ�֪ʶ�ۺ����������Ŀ��飬�������ճ����л���ṹ������Ϊ���ؼ���ע�����Ŀ��Ӧ��Ϣ���������ã���Ŀ�ѶȲ���

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | �峿�������ï�ܵ���ľ֦Ҷ�������������Ĺ��� | |
| B�� | ��FeCl3��Һ�еμ�NaOH��Һ���ֺ��ɫ���� | |
| C�� | ������˥�ߵȼ�����������ж��������ð�Ĥ����ѪҺ�� | |
| D�� | �ں�ˮ���ˮ���紦�����γ������� |
| A�� |  CH3+Cl2$\stackrel{����}{��}$ CH3+Cl2$\stackrel{����}{��}$ CH2Cl+HCl CH2Cl+HCl | |
| B�� | 2CH3CH2OH+O2$\stackrel{Cu}{��}$ 2CH3CHO+2H2O | |
| C�� | ClCH2�TCH2+NaOH$��_{��}^{ˮ}$ HOCH2CH�TCH2+NaCl | |
| D�� |  +HONO2$��_{��}^{Ũ����}$ +HONO2$��_{��}^{Ũ����}$ NO2+H2O NO2+H2O |
| A�� | ��ͬ��ͬѹʱ����ͬ������κ����嵥��������ԭ����Ŀ��ͬ | |
| B�� | 2 g��������ԭ����ĿΪNA | |
| C�� | �ڳ��³�ѹ�£�11.2 L����������ԭ����ĿΪNA | |
| D�� | 17 g��������ԭ����ĿΪ4 NA |
����β���е���Ҫ��Ⱦ����NO��CO��Ϊ���������Ⱦ���������ͨ�����·�Ӧ����������β����
��1 ��2NO(g)+2CO(g)
��2NO(g)+2CO(g) 2CO2(g)+N2(g)��H=��746.5kJ•mol��1������Ϊʹ�ô�����
2CO2(g)+N2(g)��H=��746.5kJ•mol��1������Ϊʹ�ô�����
��֪��2C(s)+O2(g) 2CO(g)��H=��221.0kJ•mol��1
2CO(g)��H=��221.0kJ•mol��1
C(s)+O2(g) CO2(g)��H=��393.5kJ•mol��1
CO2(g)��H=��393.5kJ•mol��1
��N2(g)+O2(g)=2NO(g) ��H = kJ•mol��1��
��2��T ���£���һ�ݻ�������ܱ������У�ͨ��һ������NO��CO�������崫������ò�ͬʱ��NO��CO��Ũ�����±�
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10��4 mol/L | 10.0 | 4.50 | c1 | 1.50 | 1.00 | 1.00 |
c(CO)/10��3 mol/L | 3.60 | 3.05 | c2 | 2.75 | 2.70 | 2.70 |
��c2��������ֵΪ ������ĸ��ţ���
A��4.20 B��4.00 C��2.95 D��2.80
��3������ͬ���ʵ�����H2O(g)��CO(g)�ֱ�ͨ�����Ϊ2 L�ĺ����ܱ������У����з�Ӧ��H2O(g)+CO(g) CO2(g)+H2(g)���õ������������ݣ�
CO2(g)+H2(g)���õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | c | d | t |
��a=2��b=1����c= ����ƽ��ʱʵ����ii��H2O(g)��ʵ����iii��CO��ת���ʵĹ�ϵΪ��ii��H2O�� ��iii��CO�������������������=������
��4���������������Դ����CO�ڴ����������Ʊ������ѵķ�Ӧԭ��Ϊ��2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�
CH3OCH3(g)+H2O(g)����֪һ�������£��÷�Ӧ��CO��ƽ��ת�������¶ȡ�Ͷ�ϱ�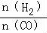 �ı仯������ͼ1��ʾ��
�ı仯������ͼ1��ʾ��

�� a��b��c���Ӵ�С��˳������Ϊ ��
�� ����ͼ������жϸ÷�ӦΪ ��Ӧ�������Ȼ���ȣ���
��5��CO�����ǵĴ������ɲⶨ����β���Ƿ�����ŷű����÷����ǵĹ���ԭ��������ȼ�ϵ�� �����е�����������ƣ�Y2O3��������ﯣ�ZrO2�����壬�ܴ���O2����
�����е�����������ƣ�Y2O3��������ﯣ�ZrO2�����壬�ܴ���O2����
�� �����ĵ缫��ӦʽΪ ��
�� ���������Ϊ��Դ��ͨ���������ӳ�ͼ2����X��YΪʯī��aΪ2 L 0.1 mol/L KCl��Һ���һ��ʱ���ȡ25 mL �����������Һ���μ�0.4 mol/L����õ�ͼ3���ߣ�������������ʧ����������ˮ����Һ����仯���Բ��ƣ�������ͼ2���㣬����������������һ����̼������Ϊ g��
| A�� | ǰ10min��Ӧ��ƽ������v��C��=0.1 mol/��L•min�� | |
| B�� | ��Ӧ�ﵽƽ��ʱB��ƽ��Ũ����1.5 mol•L-1 | |
| C�� | �����£�����Ӧ�������ѹ��Ϊԭ����һ�룬��D��ƽ��Ũ��С��1.0 mol•L-1 | |
| D�� | 10 min���������м���A�����½���ƽ��ʱA��ת����һ������50% |
 ��
�� �ڢ� C���ݢڢۢ٢� D���ܢڢ٢ۢ�
�ڢ� C���ݢڢۢ٢� D���ܢڢ٢ۢ�