题目内容
18.下列说法中正确的是( )| A. | O2的摩尔质量是32g | B. | 氯化钠的相对原子质量是58.5g | ||
| C. | 1molH2O的质量是18g | D. | 1molH2O含有氢原子的个数2个 |
分析 A.摩尔质量的单位错误,应该为g/mol;
B.g为质量的单位,相对原子质量和相对分子质量都没有单位;
C.根据m=nM计算出水的质量;
D.1mol水分子中含有2mol氢原子,根据N=nNA计算出含有的氢原子数.
解答 解:A.O2的摩尔质量是32g/mol,故A错误;
B.氯化钠的相对分子质量为58.5,故B错误;
C.1mol水的质量为:18g/mol×1mol=18g,故C正确;
D.1molH2O含有2molH原子,含有氢原子数为2NA,故D错误;
故选C.
点评 本题考查了物质的量的应用,题目难度不大,明确摩尔质量与质量、相对分子量之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
9.烯烃与CO、H2在催化剂作用下生成醛的反应叫烯烃的醛化反应.乙烯的醛化反应为;CH2=CH2+CO+H2$\stackrel{催化剂}{→}$ ,由分子式为C4H8的烯烃进行醛化反应,得到醛的同分异构体的数目为( )
,由分子式为C4H8的烯烃进行醛化反应,得到醛的同分异构体的数目为( )
 ,由分子式为C4H8的烯烃进行醛化反应,得到醛的同分异构体的数目为( )
,由分子式为C4H8的烯烃进行醛化反应,得到醛的同分异构体的数目为( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
6.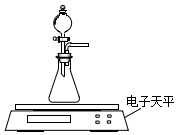 碳酸钙、盐酸是中学化学实验中的常用试剂.
碳酸钙、盐酸是中学化学实验中的常用试剂.
(1)甲同学拟测定CaCO3固体与过量0.1mol•L-1 HCl的反应速率.
①该反应的离子方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
②设计实验方案:通过测量生成二氧化碳的体积和反应时间或消耗碳酸钙固体的质量和反应时间计算反应速率
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.电子天平限选试剂与用品:0.1mol•L-1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定生成等质量二氧化碳所需时间
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①-⑥所代表的必要数据或物理量
 碳酸钙、盐酸是中学化学实验中的常用试剂.
碳酸钙、盐酸是中学化学实验中的常用试剂.(1)甲同学拟测定CaCO3固体与过量0.1mol•L-1 HCl的反应速率.
①该反应的离子方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
②设计实验方案:通过测量生成二氧化碳的体积和反应时间或消耗碳酸钙固体的质量和反应时间计算反应速率
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.电子天平限选试剂与用品:0.1mol•L-1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定生成等质量二氧化碳所需时间
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①-⑥所代表的必要数据或物理量
| 物理量 实验序号 | V(0.1mol•L-1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
| 实验1 | a | b | 0 | c | d | |
| 实验2 | ① | 0 | ③ | c | d | |
| 实验3 | c | ② | 0 | ④ | d |
3.下列应用或事实与胶体的性质无关的是( )
| A. | 清晨的阳光穿过茂密的林木枝叶所产生的美丽的光线 | |
| B. | 向FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 | |
| C. | 肾功能衰竭等疾病引起的尿中毒,可利用半透膜进行血液透析 | |
| D. | 在海水与河水交界处,易形成三角洲 |
10.关于1.5mol NH3的说法错误的是( )
| A. | 摩尔质量为17 g•mol-1 | |
| B. | 所含的分子数目约为9.03×1023 | |
| C. | 在标准状况下体积约为33.6L | |
| D. | 溶于水制成0.5L溶液时物质的量浓度为1.5mol•L-1 |
 .
.