题目内容
2.已知;Si-Cl键、H-H键、H-Cl键、Si-Si键的键能分别为a kJ•mol-1、b kJ•mol-1、c kJ•mol-1、d kJ•mol-1,1mol硅晶体含2mol Si-Si键.工业上,提纯硅的化学方程式是SiCl4(g)+2H2(g)═Si(s)+4HCl(g) 则该反应的反应热是(4a+2b-4c-2d)kJ/mol.分析 化学反应方程式中的反应热=反应物的键能之和-生成物的键能之和.在硅晶体中每个硅原子和其它4个硅原子形成4个共价键,所以每个硅原子含有2个共价键.
解答 解:反应热=反应物的键能之和-生成物的键能之和,即△H=akJ/mol×4+bkJ/mol×2-dkJ/mol×2-ckJ/mol×4=+(4a+2b-4c-2d)kJ/mol,
故答案为:(4a+2b-4c-2d)kJ/mol.
点评 本题考查反应热的计算,题目侧重于考查利用键能来计算反应热,题目难度不大,注意原子晶体中化学键数目的计算.

练习册系列答案
相关题目
13.下列表示方法正确的是( )
| A. | HCl的电子式为 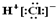 | B. | N2的结构式 N≡N | ||
| C. | O原子处于基态的轨道表示式: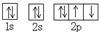 | D. | 用电子式表示MgCl2的形成: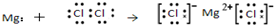 |
10.向一个2L容密闭容器中充入3.6molN2和10.8molH2,一定的条件下反应生成NH3,10min后测得N2的浓度是0.8mol•L-1,则在这10min内NH3的平均反应速率是( )
| A. | 0.1 mol•L-1•min-1 | B. | 0.2 mol•L-1•min-1 | ||
| C. | 0.3 mol•L-1•min-1 | D. | 0.6 mol•L-1•min-1 |
7.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1 NaHCO3溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO32-)>c(OH-) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol•L-1 CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
12.下列说法正确的是( )
| A. | 钾(K)原子基态的原子结构示意图为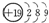 | |
| B. | Ca2+电子排布式为1s22s22p63s23p64s2 | |
| C. | 原子核内有10个中子的氧原子可表示为${\;}_{8}^{16}$O | |
| D. | H2O分子的电子式为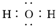 |
 ;
; .
.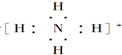 .
. ;
; .
.