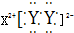题目内容
13.下列表示方法正确的是( )| A. | HCl的电子式为 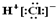 | B. | N2的结构式 N≡N | ||
| C. | O原子处于基态的轨道表示式: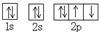 | D. | 用电子式表示MgCl2的形成: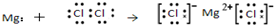 |
分析 A.HCl为共价化合物;
B.氮气分子中氮原子之间形成3对共用电子对,用短线“-”代替共用电子对即为结构式,注意未成键的孤对电子不需要标出;
C.根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同;
D.从用电子式表示物质的形成过程来判断.
解答 解:A.HCl为共价化合物,电子式中不存在离子,故A错误;
B.氮气分子中氮原子之间形成3对共用电子对,N2结构式为N≡N,故B正确;
C.根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同,故C错误;
D.用电子式表示物质的形成过程时,箭头左方应写出原子的电子式,右方写出物质的电子式,故D错误.
故选B.
点评 本题考查常用化学用语的书写,涉及电子式、结构式、轨道表示式及电子式表示形成过程等,难度中等,A选项为易错点,注意利用8电子结构分析解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下面是某科学兴趣小组的同学做同周期元素性质递变规律的实验时,设计了一套实验方案.其中实验步骤如下:
请整理并完成实验报告.
(1)实验目的:探究同周期元素性质的递变规律.
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na 2S溶液,AlCl 3溶液,NaOH溶液等.
仪器:①试管,②酒精灯,③胶头滴管,试管夹,镊子,小刀,玻璃片,砂纸等.
(3)实验内容:(完成下列表格中的实验现象和化学方程式)
(4)实验结论:同周期元素随原子序数的递增,失电子能力逐渐减弱,得电子能力逐渐增强.
(5)请用原子结构的知识简单解释上述结论.
| 实验序号 | 实验步骤 |
| ① | 将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
| ② | 向新制得的Na 2S溶液中滴加新制的氯水 |
| ③ | 将一小块金属钠放入滴有酚酞溶液的冷水中 |
| ④ | 将镁条投入稀盐酸中 |
| ⑤ | 将铝条投入稀盐酸中 |
| ⑥ | 向AlCl 3溶液中滴加NaOH溶液至过量 |
(1)实验目的:探究同周期元素性质的递变规律.
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na 2S溶液,AlCl 3溶液,NaOH溶液等.
仪器:①试管,②酒精灯,③胶头滴管,试管夹,镊子,小刀,玻璃片,砂纸等.
(3)实验内容:(完成下列表格中的实验现象和化学方程式)
| 实验序号 | 实验步骤(略) | 实验现象 | 化学方程式 |
| ① | |||
| ② | |||
| ③ | |||
| ④ | |||
| ⑤ | |||
| ⑥ |
(5)请用原子结构的知识简单解释上述结论.
5.下列关系正确的是( )
| A. | 熔点:正戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CCl4>H2O>苯 | |
| C. | 同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷 | |
| D. | 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
3.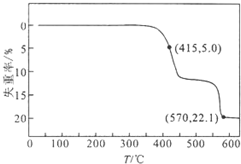 HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2C2O4+H2↑①
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2↑+CO↑②
Na2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO↑③
下列说法正确的是( )
 HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2C2O4+H2↑①
2HCOONa$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2↑+CO↑②
Na2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO↑③
下列说法正确的是( )
| A. | T<415℃,只有反应①发生 | |
| B. | 反应①、②不可能同时发生 | |
| C. | 570℃<T<600℃时,残留固体的主要成分是Na2CO3 | |
| D. | 残留固体中的m(Na2C2O4)=m(Na2CO3)时,反应①、③的反应速率相等 |
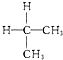 与
与 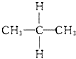
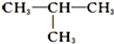
 ;
;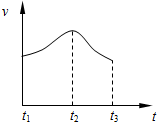 把除去氧化膜的镁条投入到盛有稀HCl的试管中,发现氢气发生的速率变化情况如图所示.
把除去氧化膜的镁条投入到盛有稀HCl的试管中,发现氢气发生的速率变化情况如图所示. ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.