题目内容
18.按要求完成下列填空:(1)泡沫灭火器灭火时发生反应的离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(2)0.1mol•L-1(NH4)2SO4溶液
写出物料守恒式2c(SO42-)=c(NH4+)+c(NH3•H2O);电荷守恒式2c(SO42-)+c(OH-)=c(NH4+)+c(H+);
质子守恒式c(H+)=c(OH-)+c(NH3•H2O);离子浓度大小关系c(NH4+)>c(SO42-)>c(H+)>c(OH-).
(3)0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合
写出物料守恒式2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3);电荷守恒式c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-).
(4)25℃,浓度相同的NH4Cl与NH3•H2O等体积混合,混合后pH=10
写出物料守恒式2c(Cl-)=c(NH4+)+c(NH3•H2O);电荷守恒式c(Cl-)+c(OH-)=c(NH4+)+c(H+);离子浓度大小关系c(NH4+)>c(Cl-)>c(OH-)>c(H+).
(5)Mg(OH)2在下列四种情况下,其溶解度大小关系为C.
A.在纯水中 B.在0.1mol•L-1的MgCl2溶液中 C.在0.1mol•L-1的CH3COOH溶液中
(6)向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,
再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为AgCl>AgI>Ag2S,写出白色沉淀转化成黄色沉淀的离子方程式AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).
分析 (1)硫酸铝和碳酸氢钠能发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
(2)0.1mol•L-1(NH4)2SO4溶液中铵根离子水解,溶液显酸性,判断离子浓度大小,氮元素所有存在形式和硫酸根离子浓度存在物料守恒,n(N)=2n(SO42-);溶液中阴阳离子所带电荷总数相同,存在电荷守恒;铵根离子水解促进水的电离,水电离出的所有氢离子浓度和氢氧根离子浓度相同;
(3)0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合溶液中存在电荷守恒,溶液中阴阳离子所带电荷总数相同,物料守恒2n(Na)=3n(C);
(4)25℃,浓度相同的NH4Cl与NH3•H2O等体积混合,混合后pH=10,溶液显碱性,说明铵根离子水解程度小于一水合氨电离程度;溶液中存在物料守恒2n(Cl)=
c(N),溶液中阴阳离子所带电荷总数相同,存在电荷守恒;
(5)Mg(OH)2在溶液中存在溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(ag),平衡右移,溶解度增大,反之减小,据此解答即可;
(6)根据沉淀转化的实质,一种难溶物转化成另一种更难溶的物质分析判断;沉淀之所以发生转化是由于添加的离子破坏了原有的沉淀溶解平衡,从而导致沉淀溶解平衡的移动.沉淀转化的方向:一般向着溶解度小的物质方向转化.
解答 解:(1)硫酸铝和碳酸氢钠能发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(2)0.1mol•L-1(NH4)2SO4溶液中存在物料守恒,n(N)=2n(SO42-),离子浓度大小关系为:2c(SO42-)=c(NH4+)+c(NH3•H2O),溶液中电荷守恒为:2c(SO42-)+c(OH-)=c(NH4+)+c(H+),溶液中的质子守恒为:c(H+)=c(OH-)+c(NH3•H2O),0.1mol•L-1(NH4)2SO4溶液中铵根离子水解,溶液显酸性溶液中 离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:2c(SO42-)=c(NH4+)+c(NH3•H2O),2c(SO42-)+c(OH-)=c(NH4+)+c(H+),c(H+)=c(OH-)+c(NH3•H2O),c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(3)0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合溶液中存在电荷守恒,溶液中阴阳离子所带电荷总数相同,电荷守恒为:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),物料守恒2n(Na)=3n(C),2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3),
故答案为:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3),c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-);
(4)25℃,浓度相同的NH4Cl与NH3•H2O等体积混合,混合后pH=10,溶液显碱性,说明铵根离子水解程度小于一水合氨电离程度,溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),溶液中存在物料守恒2n(Cl)=c(N),2c(Cl-)=c(NH4+)+c(NH3•H2O)溶液中阴阳离子所带电荷总数相同,存在电荷守恒:c(Cl-)+c(OH-)=c(NH4+)+c(H+),
故答案为:2c(Cl-)=c(NH4+)+c(NH3•H2O),c(Cl-)+c(OH-)=c(NH4+)+c(H+),c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(5)Mg(OH)2在溶液中存在溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(ag),
A、在纯水中,溶解度不大,故A错误;
B、加入镁离子,平衡左移,抑制的氢氧化镁的溶解,故B错误,
C、加入CH3COOH,醋酸与氢氧根反应,故平衡右移,溶解度增大,故C正确;
故答案为:C;
(6)沉淀之所以发生转化是由于添加的离子破坏了原有的沉淀溶解平衡,从而导致沉淀溶解平衡的移动.沉淀转化的方向:一般向着溶解度小的物质方向转化,或者说对于沉淀类型相同的物质,一般向着Ksp减小的方向进行;向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为淡黄色,再滴加一滴Na2S溶液并振荡,沉淀又变为黑色,根据上述变化过程中的沉淀现象可知,沉淀溶解度大小为:AgCl>AgI>Ag2S,白色沉淀转化成黄色沉淀的离子方程式为:AgCl(s)+I-(aq)=AgI(s)+Cl-(aq),
故答案为:AgCl>AgI>Ag2S;AgCl(s)+I-(aq)=AgI(s)+Cl-(aq).
点评 本题考查了盐类水解、电解质溶液中电荷守恒、物料守恒、质子守恒等离子浓度关系的理解应用,酸碱反应后溶液酸碱性判断等知识点,题目难度中等.

| A. | 硝酸和氢氧化钠 | B. | 盐酸和氨水 | C. | 硫酸和氢氧化钾 | D. | 醋酸和氢氧化钡 |
| A. | 固体氯化铵和消石灰共热 | B. | 加热浓氨水 | ||
| C. | 浓氨水滴加到碱石灰中 | D. | 加热固体氯化铵 |
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:(1)该小组同学向5mLlmol/LFeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(2)向5mLlmol/LFeCl3溶液中通人足量的SO2,在实验时,溶液由棕黄色变成红棕色,最终溶液呈浅绿色.
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色,能被Fe3+氧化为SO${\;}_{4}^{2-}$.
Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为缩短红棕色变为浅绿色的时间,进行了如下实验:
向步骤①和步骤②所得溶液中滴加K3[Fe(CN)6](添化学式)试剂,溶液立即出现蓝色沉淀.
| 步骤① | 往5mL1mol/LFeCl3溶液中通入SO2气体,溶液立即变为红棕色,微热在较短时间内溶液颜色变为浅绿色. |
| 步骤② | 往5mL重新配制的1mol/LFeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色,短时间内溶液颜色变为浅绿色. |
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间.
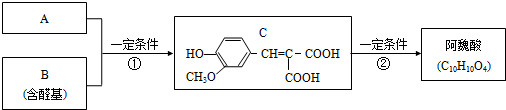
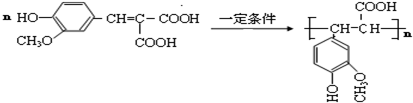 .
.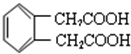 .
.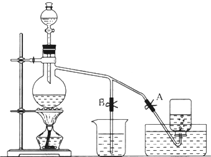 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.) 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.50 mol/L盐酸,加入盐酸的体积(V)与沉淀质量(W)变化关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.50 mol/L盐酸,加入盐酸的体积(V)与沉淀质量(W)变化关系如图所示: