题目内容
13.向10mL浓度为2mol/LH NO3与3mol/L H2SO4的混合溶液中加入1.92克铜,充分反应后,设溶液体积仍为10mL.求:(1)产生的气体在标准状况下的体积为多少升?
(2)反应后溶液中各溶质的离子浓度是多少?
分析 溶液中的氢离子既包括硝酸电离的又包括硫酸电离的.所以n(H+)=2mol•L-1×0.01L×1+3mol•L-1×0.01L×2=0.08mol,n(NO3-)=2mol•L-1×0.01L=0.02mol,
n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,结合反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O解答该题.
解答 解:溶液中的氢离子既包括硝酸电离的又包括硫酸电离的.所以n(H+)=2mol•L-1×0.01L×1+3mol•L-1×0.01L×2=0.08mol,n(NO3-)=2mol•L-1×0.01L=0.02mol,
n(Cu)=$\frac{1.92g}{64g/mol}$=0.02mol,则
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3 8 2 3 2
0.03 0.08 0.02
可知Cu、H+和NO3-恰好完全反应,则
(1)由反应的离子方程式可知n(NO)=0.02mol,V(NO)=0.02mol×22.4L/mol=0.448L,
答:产生的气体在标准状况下的体积是0.448L;
(2)0.03molCu完全反应,则生成0.03molCu2+,
所以反应后溶液中c(Cu2+)=$\frac{0.03mol}{0.01L}$=3mol/L,
由于SO42-没有参加反应,反应后的浓度仍为3mol/L,
答:反应后溶液中各溶质离子物质的量浓度分别是Cu2+:3mol/L、SO42-:3mol/L.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,注意把握相关反应的离子方程式的书写,根据方程式计算该题,难度不大.

练习册系列答案
相关题目
2.“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是( )
| A. | 构造原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
3.下列说法正确的是( )
| A. | 常温下,强酸溶液的pH=a将溶液的体积稀释到原来10n倍,则pH=a+n | |
| B. | 已知 BaSO4的Ksp=c(Ba2+)•c(SO${\;}_{4}^{2-}$),所以在 BaSO4,溶液中有 c(Ba2+)=c(SO${\;}_{4}^{2-}$)=$\sqrt{{K}_{sp}}$ | |
| C. | 向硝酸押溶液中滴加稀盐酸得到的pH=4的混合溶液:c(k+)<c(NO${\;}_{3}^{-}$) | |
| D. | 将0.1mol•L-1的MaHS和0.1molL-1Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(0H-)=2c(H+)+c(HS-)+3c(H2S) |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
 .
. 2NH3
2NH3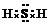 .
.