题目内容
9.下列方法不能用于实验室制取氨气的是( )| A. | 固体氯化铵和消石灰共热 | B. | 加热浓氨水 | ||
| C. | 浓氨水滴加到碱石灰中 | D. | 加热固体氯化铵 |
分析 A.氯化铵与氢氧化钙加热生成氨气、氯化钙和水;
B.浓氨水易挥发,加热促进浓氨水的挥发;
C.利用CaO与H2O剧烈反应,放出大量热,促进NH3•H2O的分解及NH3的挥发逸出;
D.加热氯化铵生成氨气和氯化氢,氨气和氯化氢遇冷又生成氯化铵,很难制取氨气.
解答 解:A.氯化铵与氢氧化钙加热生成氨气、氯化钙和水,方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,可以用来制备氨气,故A不选;
B.浓氨水易挥发,加热促进浓氨水的挥发,可以用来制备氨气,故B不选;
C.CaO与H2O剧烈反应,生成Ca(OH)2,放出大量热,促进NH3•H2O的分解及NH3的挥发逸出,又由于Ca(OH)2是强碱,也促进NH3•H2O的分解及NH3的挥发逸出,反应的化学方程式为:NH3•H2O+CaO═NH3↑+Ca(OH)2,故C不选;
D.氯化铵受热分解成氨气和氯化氢,但氨气和氯化氢一冷却马上又可以化合成氯化铵,这个方案很难制氨气,故D选;
故选D.
点评 本题考查氨气的实验室制法,掌握实验室制取氨气的反应原理,并会根据反应原理选择实验装置是解答的关键,题目难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
20.下列物质不能使酸性高锰酸钾溶液褪色的是( )
| A. | 甲苯 | B. | 苯 | C. | 乙烯 | D. | 乙炔 |
14.下列物质中不能用金属单质和非金属单质直接化合制得的是( )
| A. | CuO | B. | FeC13 | C. | CuS | D. | FeS |
19.下列有关化学药品的保存和运输不正确的是( )
| A. | 浓硝酸应保存在棕色试剂瓶并置于阴凉处 | |
| B. | 氢氟酸不能装在玻璃瓶,应装在塑料瓶中 | |
| C. | NaOH溶液用带磨口玻璃瓶塞的试剂瓶保存 | |
| D. | 常温下浓硫酸和浓硝酸可以铁制槽罐车运输 |
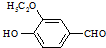 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.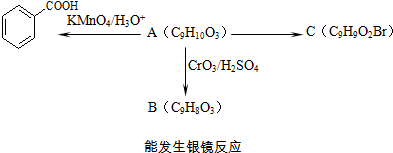
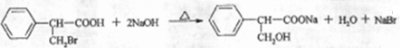
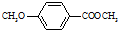 )是一种医药中间体.
)是一种医药中间体. )合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭头下方,试剂或原料写在箭头上方,中间产物填在图中的方框内.
)合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭头下方,试剂或原料写在箭头上方,中间产物填在图中的方框内.
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
 .
. 2NH3
2NH3