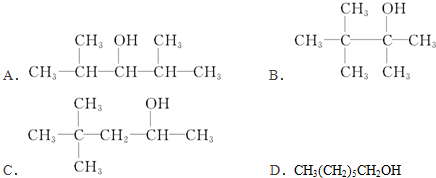题目内容
16.已知某酸H2A在水中存在下列电离:①H2A=H++HA- ②HA-?H++A2-,下列说法一定正确的是( )| A. | Na2A溶液中一定有:c(OH-)=c(H+)+c(HA-) | |
| B. | Na2A溶液呈碱性,NaHA溶液可能酸性可能呈碱性 | |
| C. | Na2A溶液中一定有c(Na+)+c(H+)=c(OH-)+c(A2-)+c(HA-) | |
| D. | NaHA溶液一定有c(Na+)>c(HA)>c(OH-)>c(H2A)>c(H+) |
分析 该二元酸第一步完全电离,第二步部分电离,根据物料守恒和电荷守恒确定离子浓度关系,注意HA-只电离不水解,
A.根据Na2A溶液中的物料守恒和电荷守恒分析;
B.HA-只电离不水解,则NaHA溶液呈酸性;
C.根据溶液中的电荷守恒判断;
D.HA-不水解只电离,则溶液中不存在H2A,溶液呈酸性,c(H+)>c(OH-),结合电荷守恒判断.
解答 解:A.根据Na2A溶液中的电荷守恒知:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),根据物料守恒得:c(Na+ )=2c(A2-)+2c( HA-),二者结合可得:c(OH-)=c(H+)+c(HA-),故A正确;
B.Na2A溶液中A2-水解溶液呈碱性,而NaHA溶液中HA-只电离不水解,则NaHA溶液呈酸性,故B错误;
C.根据Na2A溶液中的电荷守恒知:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故C错误;
D.NaHA溶液中,HA-不水解只电离,溶液显示酸性,则c(Na+)<c(HA-)、c(OH-)<c(H+),且溶液中不存在H2A,正确的离子浓度大小为:c(HA-)>c(Na+)>c(H+)>c(OH-),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确酸H2A的电离特点为解答关键,注意HA-不水解只电离,为易错点,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案
相关题目
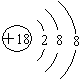
7.Ge 和Sn 的熔点( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能肯定 |
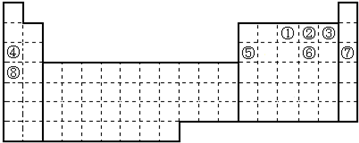
1.按核外电子排布,可把周期表里的元素划分成5个区,以下元素属于s区的是( )
| A. | Fe | B. | P | C. | Mg | D. | Cu |
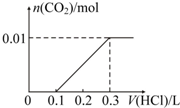

 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$
 .
. .
.
 .
.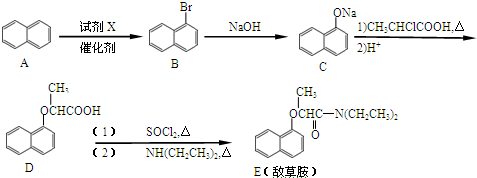
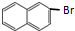 .
.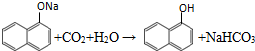 ;
;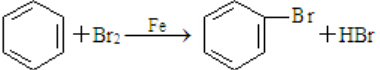 、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
、C6H5Br+NaOH$→_{△}^{水}$C6H5OH+NaBr、C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.