题目内容
5.关于氧化还原反应和离子反应,下列说法正确的是( )①金属在反应中只能作还原剂,非金属在反应中只能作氧化剂;
②氧化剂发生氧化反应;
③还原剂失去电子,化合价升高;
④溶液中的离子反应不可能是氧化还原反应;
⑤发生离子反应后,溶液的导电性减弱.
| A. | ①②④ | B. | ①③⑤ | C. | ②③⑤ | D. | 只有③ |
分析 ①非金属在反应中能作氧化剂,也可能作还原剂;
②氧化剂得电子发生还原反应;
③还原剂被氧化;
④溶液中的离子反应也可能存在化合价的变化;
⑤溶液中离子浓度增大,导电性增强.
解答 解:①金属在反应中只能失电子,只能作还原剂,非金属在反应中能作氧化剂,也可能作还原剂,如硫在空气中燃烧,硫作还原剂,故错误;
②氧化剂得电子,化合价降低,发生还原反应,故错误;
③氧化还原反应中失电子的物质反应是还原剂,所以还原剂化合价升高失电子,被氧化,故正确;
④溶液中的离子反应也可能存在化合价的变化,如铁离子与Cu反应生成亚铁离子和铜离子,是离子反应也是氧化还原反应,故错误;
⑤溶液中离子浓度增大,导电性增强,如醋酸溶液中加少量的氢氧化钠固体,溶液中离子浓度增大,导电性增强,故错误.
故选D.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化和离子反应的特点为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列有关实验原理、现象、结论等均正确的是( )
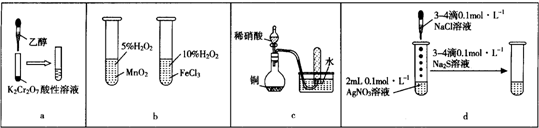

| A. | a图示装置,滴加乙醇试管中橙色溶液变为绿色,乙醇发生消去反应生成乙酸 | |
| B. | b图示装置,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好 | |
| C. | c图示装置,根据试管中收集到无色气体,验证铜与稀硝酸的反应产物是NO | |
| D. | d图示装置,试管中先有白色沉淀、后有黑色沉淀,不能验证AgCl的溶解度大于Ag2S |
16.已知某酸H2A在水中存在下列电离:①H2A=H++HA- ②HA-?H++A2-,下列说法一定正确的是( )
| A. | Na2A溶液中一定有:c(OH-)=c(H+)+c(HA-) | |
| B. | Na2A溶液呈碱性,NaHA溶液可能酸性可能呈碱性 | |
| C. | Na2A溶液中一定有c(Na+)+c(H+)=c(OH-)+c(A2-)+c(HA-) | |
| D. | NaHA溶液一定有c(Na+)>c(HA)>c(OH-)>c(H2A)>c(H+) |
13.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),达到平衡时,测的A的浓度为0.5mol/L,在温度不变的条件下,将容器的体积扩大到两倍,使再达到平衡,测的A的浓度降低为0.3mol/L,下列有关判断正确的是( )
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | A的体积分数下降 | D. | B的浓度增大 |
17.检验某无SO42-的溶液中是否含有Cl-,正确的操作是( )
| A. | 取样,滴加AgNO3溶液,看是否有白色沉淀 | |
| B. | 取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取样,加少量AgNO3溶液,有白色沉淀,再加稀HCl,看白色沉淀是否消失 | |
| D. | 取样,加少量AgNO3溶液,有白色沉淀,再加稀HNO3,看白色沉淀是否消失 |
14.对下图有机物的命名正确的是( )
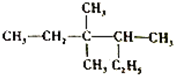

| A. | 2-乙基-3,3-二甲基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 3,3-甲基-4乙基戊烷 | D. | 2,3,3-三甲基己烷 |
15.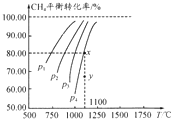 在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )
在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )
 在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )
在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )| A. | 上述反应的△H<0 | |
| B. | 压强P1>P2>P3>P4 | |
| C. | 1100℃时该反应的平衡常数约为1.64 | |
| D. | 压强为P4时,y点的v正<v逆 |
 某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.