题目内容
11.元素①~⑧在元素周期表中的位置如下,回答有关问题: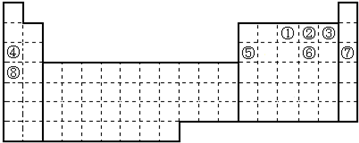
(1)画出⑦的原子结构示意图
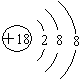 .
.(2)写出②含有10个中子的核素的化学符号818O.
(3)已知元素的非金属性:②<③,则氢化物的稳定性由强到弱的顺序为HF>H2O(填化学式).
(4)请写出①的氢化物发生催化氧化的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(5)表中能形成两性氢氧化物的元素是Al(填元素符号),写出该元素的单质与⑧的最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 由元素的位置可知,①~⑧分别为N、O、F、Na、Al、S、Ar、K,
(1)Ar的原子结构中有3个电子层,最外层电子数为8;
(2)②含有10个中子的核素,质量数为18;
(3)非金属性越强,气态氢化物越稳定;
(4)氨气催化氧化生成NO和水;
(5)Al的氢氧化物具有两性,Al与KOH反应生成偏铝酸钾和氢气.
解答 解:由元素的位置可知,①~⑧分别为N、O、F、Na、Al、S、Ar、K,
(1)Ar的原子结构中有3个电子层,最外层电子数为8,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)②含有10个中子的核素,质量数为18,化学符号为818O,故答案为:818O;
(3)非金属性越强,气态氢化物越稳定,氢化物的稳定性由强到弱的顺序为HF>H2O,故答案为:HF>H2O;
(4)氨气催化氧化生成NO和水,化学反应为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(5)Al的氢氧化物具有两性,Al与KOH反应生成偏铝酸钾和氢气,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:Al;2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律及元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.在某无色透明溶液中,能大量共存的离子组是( )
| A. | Fe3+、K+、SO42- | B. | Cu2+、SO42-、NO3- | C. | Na+、K+、Cl- | D. | MnO4-、K+、SO42- |
6.下列离子方程式正确的是( )
| A. | 镁与稀硝酸反应:Mg+2H+═Mg2++H2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁腐蚀印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 硫酸溶液与氢氧化钡溶液反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
16.已知某酸H2A在水中存在下列电离:①H2A=H++HA- ②HA-?H++A2-,下列说法一定正确的是( )
| A. | Na2A溶液中一定有:c(OH-)=c(H+)+c(HA-) | |
| B. | Na2A溶液呈碱性,NaHA溶液可能酸性可能呈碱性 | |
| C. | Na2A溶液中一定有c(Na+)+c(H+)=c(OH-)+c(A2-)+c(HA-) | |
| D. | NaHA溶液一定有c(Na+)>c(HA)>c(OH-)>c(H2A)>c(H+) |
3.短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期.X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1.下列比较正确的是( )
| A. | 元素的单质氧化性:Z>Y>X | B. | 最高正化合价:Z>Y | ||
| C. | 原子半径:Z<Y<X | D. | 气态氢化物的稳定性:Z<Y<X |
 硝基还原为氨基:
硝基还原为氨基: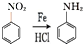
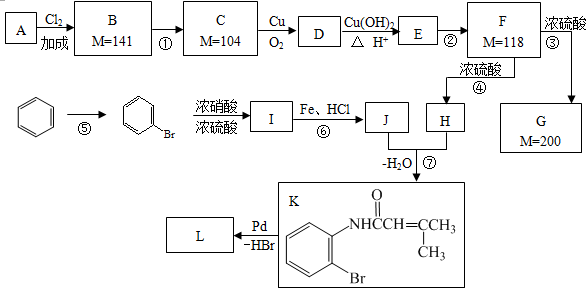
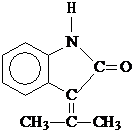 .
.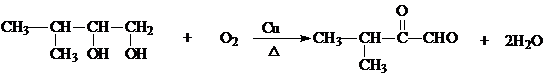 .
. .
.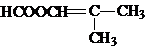 .
.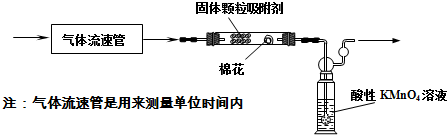
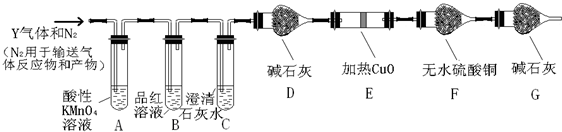
 某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.