题目内容
1.按核外电子排布,可把周期表里的元素划分成5个区,以下元素属于s区的是( )| A. | Fe | B. | P | C. | Mg | D. | Cu |
分析 电子排布中最后填充的电子为s电子,为s区元素,以此来解答.
解答 解:A.Fe的外围电子排布为3d64s2,属于d区元素,故A不选;
B.P的外围电子排布为3s23p4,所以p区元素,故B不选;
C.Mg的外围电子排布为3s2,属于s区元素,故C选;
D.Cu属于d区元素,故D不选;
故选C.
点评 本题考查原子的电子排布及周期表的分区,为高频考点,把握电子排布中最后填充的电子为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
16.已知某酸H2A在水中存在下列电离:①H2A=H++HA- ②HA-?H++A2-,下列说法一定正确的是( )
| A. | Na2A溶液中一定有:c(OH-)=c(H+)+c(HA-) | |
| B. | Na2A溶液呈碱性,NaHA溶液可能酸性可能呈碱性 | |
| C. | Na2A溶液中一定有c(Na+)+c(H+)=c(OH-)+c(A2-)+c(HA-) | |
| D. | NaHA溶液一定有c(Na+)>c(HA)>c(OH-)>c(H2A)>c(H+) |
6.一定温度下,在三个体积均为1.0L恒容密闭容器中发生反应:
下列说法正确的是( )
下列说法正确的是( )
| 窗口编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
 |  | H2(g) | ||
| 1 | 380 | 0.10 | 0.60 | 0.060 |
| 2 | 380 | 0.20 | ||
| 3 | 230 | 0.10 | 0.050 | 0.050 |
| A. | 该反应的正反应为放热反应 | |
| B. | 达到平衡时,容器I中的H2体积分数比容器Ⅱ中的小 | |
| C. | 容器I中反应达到平衡所需的时间比容器Ⅲ中的长 | |
| D. | 若起始时向容器Ⅲ中充入0.10mol (g)、0.10mol (g)、0.10mol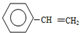 (g)和0.10mol H2,则反应向逆反应方向进行 (g)和0.10mol H2,则反应向逆反应方向进行 |
13.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),达到平衡时,测的A的浓度为0.5mol/L,在温度不变的条件下,将容器的体积扩大到两倍,使再达到平衡,测的A的浓度降低为0.3mol/L,下列有关判断正确的是( )
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | A的体积分数下降 | D. | B的浓度增大 |
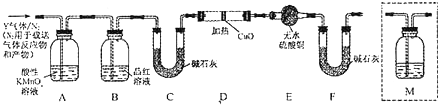
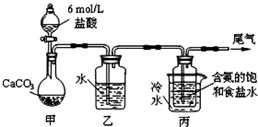 碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.
碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.