题目内容
12.二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池,具有很好的发展前景.(1)已知H2、CO和CH3OCH3的燃烧热(△H)分别为-285.5kJ/mol、-283kJ/mol和-1460.0kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)△H=-245.5kJ•mol-1.
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2,将悬浮物带到水面,利于除去.实验室以二甲醚燃料电池模拟该方法设计的装置如图所示:
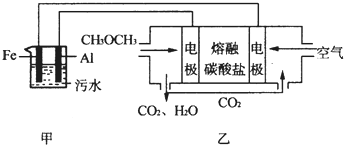
①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极.写出该燃料电池的正极电极反应式O2+4e-+2CO2=2CO32-;下列物质可用做电池熔融碳酸盐的是B.
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)2CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式4Fe2++O2+10H2O=4Fe(OH)3↓+8H+.
③已知常温下Ksp[Fe(OH)3]=4.0×10-38,电解一段时间后,甲装置中c(Fe3+)=4.0×10-11mol/L.
④已知:H2S的电离平衡常数:K1=9.1×10-8、K2=1.1×10-12;H2CO3的电离平衡常数:K1=4.31×10-7、K2=5.61×10-11.测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列选项正确的是BCE
A.发生反应的离子方程式为:CO2+S2-+H2O═CO32-+H2S
B.发生反应的离子方程式为:CO2+S2-+H2O═HCO3-+HS-
C.c(Na+)═2[c(H2S)+c(HS-)+c(S2-)]
D.c(Na+)+c(H+)═2c(CO32-)+2c(S2-)+c(OH-)
E.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
分析 (1)根据盖斯定律进行计算;
(2)①燃料电池中,正极上氧化剂得电子发生还原反应;熔融碳酸盐性质要稳定,高温时不能分解;
②铁作阳极,阳极上生成Fe2+,阴极附近生成氢氧根离子,氢氧根离子和Fe2+子生成Fe(OH)2沉淀,Fe(OH)2不稳定,易被氧化生成Fe(OH)3;
③c(Fe3+)=$\frac{{K}_{sp}}{{c}^{3}(O{H}^{-})}$;
④乙装置中阴极上甲醚失电子生成二氧化碳,根据CH3OCH3---2CO2---12e-计算n(CO2)=$\frac{0.24mol}{12}$=0.04mol,n(Na2S)=0.2mol/L×0.2L=0.04mol,根据电离平衡常数知发生反应CO2+S2-+H2O═HCO3-+HS-,再结合电荷守恒和物料守恒解答.
解答 解:(1)①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.5kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol
③CH3OCH3(g)+3O2=2CO2(g)+3H2O(l)△H=-1460.0kJ/mol
用水煤气成分按1:1合成二甲醚,
将方程式3①+3②-③得:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)△H=3(-285.5kJ/mol)+3(-283kJ/mol)-(-1460.0kJ/mol)=-245.5kJ/mol,
故答案为:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)△H=-245.5kJ•mol-1;
(2)①燃料电池中,正极上氧化剂氧气得电子和二氧化碳发生还原反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-;熔融碳酸盐性质要稳定,高温时不能分解生成其它物质,
A.MgCO3高温下分解生成氧化镁和二氧化碳而得不到碳酸根离子,故错误;
B.Na2CO3性质较稳定,熔融状态下只发生电离而不发生分解反应,故正确;
C.NaHCO3性质不稳定,易分解而得不到碳酸根离子,故错误;
D.(NH4)CO3性质不稳定,易分解而得不到碳酸根离子,故错误;
故答案为:O2+4e-+2CO2=2CO32-;B;
②阳极上Fe失电子生成亚铁离子,阴极上生成氢氧根离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,被氧气氧化生成氢氧化铁,离子反应方程式为:4Fe2++O2+10H2O=4Fe(OH)3↓+8H+,
故答案为:4Fe2++O2+10H2O=4Fe(OH)3↓+8H+;
③c(Fe3+)=$\frac{{K}_{sp}}{{c}^{3}(O{H}^{-})}$=$\frac{4×1{0}^{-38}}{(\frac{1{0}^{-14}}{1{0}^{-5}})^{3}}$mol/L=4.0×10-11 mol/L,
故答案为:4.0×10-11mol/L;
④乙装置中阴极上甲醚失电子生成二氧化碳,根据CH3OCH3---2CO2---12e-计算n(CO2)=$\frac{0.12mol}{12}$=0.04mol,n(Na2S)=0.2mol/L×0.2L=0.04mol,根据电离平衡常数知发生反应CO2+S2-+H2O═HCO3-+HS-,则溶液中的溶质是等物质的量浓度的NaHCO3、NaHS,
A.根据以上分析知,发生反应的离子方程式为:CO2+S2-+H2O═HCO3-+HS-,故错误;
B.根据以上分析知,发生反应的离子方程式为:CO2+S2-+H2O═HCO3-+HS-,故正确;
C.根据物料守恒得c(Na+)=2[c(H2S)+c(HS-)+c(S2-)],故正确;
D.根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+2c(S2-)+c(OH-)+c(HS-)+c(HCO3-),故错误;
E.碳酸氢根离子和硫氢根离子都水解和电离,但程度都较小,钠离子不水解,根据电离平衡常数知,HCO3-水解程度小于HS-,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(HS-)>c(OH-),故正确;
故答案为:BCE.
点评 本题考查较综合,涉及了盖斯定律、原电池原理、离子浓度大小比较等知识点,题目难度中等,明确燃烧热的内涵、原电池原理内涵、盐类水解与弱电解质电离关系即可解答,这些知识点都是高考热点,常常以综合题大题出现,涵盖了化学反应原理所有知识,利用教材基础知识采用知识迁移的方法进行解答.

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案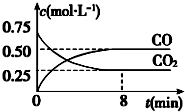 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.(1)该反应的平衡常数表达式 K=$\frac{c(CO)}{c(C{O}_{2})}$.
(2)能表明反应一定处于平衡状态的是AB(填序号).
A.固体总质量保持不变 B.气体密度不变
C.v正(Fe)=v逆(FeO) D.CO2与CO浓度相等
(3)8min 内,CO的平均反应速率v(CO)=0.0625 mol•L-1•min-1
(4)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 甲 | 乙 | |
| 量 | 3mo Fe、 mo CO | mo FeO、 3mo CO |
| CO浓度(mo•-1) | c1 | c |
| CO体积分数 | φ1 | φ |
| 体系压强(Pa) | p1 | p |
| 气态转化率 | α1 | α |
A.2c1=3c2 B.φ1=φ2
C.p1<p2 D.α1=α2
②求 c1=0.67mol•L-1、φ1=33.3%、α2=33.3%.
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(Na+)+c(H+)═c(HRO3-)+c(RO32-)+c(OH-) | |
| C. | c(RO32-)+c(HRO3-)+c(H2RO3)═c(Na+) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
| A. | 乙酸 | B. | 乙醇 | C. | 水 | D. | 乙酸乙酯 |
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | 反应①中的反应物总能量大于生成物的总能量 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),下列各项能说明反应达到平衡状态的是abc.
a.体系压强保持不变
b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变
d.每消耗1molO2同时生成2molNO2
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)?CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度(mol•L-1) | 0.9 | 1.0 | 0.6 |
②若降低温度,K值增大,则反应的△H<0(填“>”或“<”).
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正=v逆(填“>”、“<”或“=”)