题目内容
8.在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的数据是( )| A. | v(A)=0.9 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=1.4 mol/(L•s) | D. | v(D)=1.8 mol/(L•s) |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的速率越快,注意保持单位一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的速率越快,对应反应:2A(g)+B(g)=3C(g)+4D(g),
A、$\frac{vA}{2}$=0.45 mol/(L•s);
B、0.5 mol/(L•s)
C、$\frac{1.4}{3}$mol/(L•s)≈0.47mol/(L•s);
D、$\frac{1.8}{4}$mol/(L•s)=0.45mol/(L•s);故B表示的反应速率最快,
故选B.
点评 本题考查了化学反应速率快慢的比较,难度不大,注意要把不同物质的反应速率换算成同一物质的反应速率进行比较,还要注意单位是否相同.

练习册系列答案
相关题目
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含20.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.65kJ | |
| B. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则标况下1mol氢气完全燃烧放出241.8 kJ的热量 | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)=2CO(g)△H=b kJ•mol-1,则a>b | |
| D. | 已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定 |
3.下列实验操作中,所用仪器使用合理的是( )
| A. | 在容量瓶中溶解氢氧化钠固体并配制溶液 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.2gNaCl | |
| D. | 用分液漏斗来过滤NaCl溶液中泥沙 |
10.(1)某学生用标准盐酸滴定待测的NaOH溶液,根据3次实验分别记录有关数据如表:
则依据表中数据,该NaOH溶液的物质的量浓度为0.1044mol•L-1.
(2)实验室用标准盐酸溶液测定某NaOH溶液的浓度.用甲基橙作指示剂,下列操作可能使测定结果偏低的是C.
A.酸式滴定管用蒸馏水洗涤后未用标准液清洗
B.开始实验时,酸式滴定管尖咀部份有气泡,在滴定过程中气泡消失
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数
D.达到滴定终点时,仰视读数并记录
(3)准确量取25.00mL酸性高锰酸钾溶液应用酸式滴定管.(填仪器名称)
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(2)实验室用标准盐酸溶液测定某NaOH溶液的浓度.用甲基橙作指示剂,下列操作可能使测定结果偏低的是C.
A.酸式滴定管用蒸馏水洗涤后未用标准液清洗
B.开始实验时,酸式滴定管尖咀部份有气泡,在滴定过程中气泡消失
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数
D.达到滴定终点时,仰视读数并记录
(3)准确量取25.00mL酸性高锰酸钾溶液应用酸式滴定管.(填仪器名称)
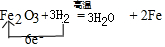 .实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.
.实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.