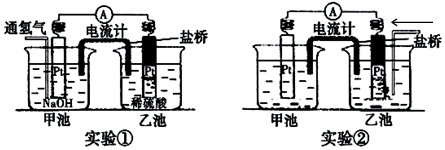
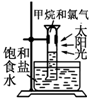
题目内容
13.草酸H2C2O4样品的质量分数用高锰酸钾法测定.称量草酸H2C2O40.500g溶于水,与0.100mol•L-1的酸性KMnO4溶液反应,至草酸完全反应消耗KMnO4溶液20.00mL,反应的方程式为5H2C2O4+2KMnO4+3H2SO4═2MnSO4+K2SO4+8H2O+10CO2↑;请计算该成品的质量分数.(列式计算,写出过程)分析 n(KMnO4)=0.02L×0.100mol/L=0.002mol,由5H2C2O4+2KMnO4+3H2SO4═2MnSO4+K2SO4+8H2O+10CO2↑可知,n(H2C2O4)=0.002mol×$\frac{5}{2}$=0.005mol,然后结合m=nM计算.
解答 解:n(KMnO4)=0.02L×0.100mol/L=0.002mol,由5H2C2O4+2KMnO4+3H2SO4═2MnSO4+K2SO4+8H2O+10CO2↑可知,n(H2C2O4)=0.002mol×$\frac{5}{2}$=0.005mol,该成品的质量分数为$\frac{0.005mol×90g/mol}{0.5g}$×100%=90%,
答:该成品的质量分数为90%.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意物质的量的相关计算,题目难度不大.

练习册系列答案
相关题目
4.工业制硝酸中的一步重要反应是N2和H2在500℃时,高压、催化剂条件下反应:N2+3H2?2NH3,这是个正反应是放热的可逆反应.已知反应在密闭容器中进行,下列说法正确的是( )
| A. | 使用催化剂能加快反应速率,使N2完全转化为NH3 | |
| B. | 当N2、H2、NH3浓度相等时,反应达到化学平衡状态 | |
| C. | 一段时间后,当N2、H2、NH3浓度不再改变时,反应物转化率最大 | |
| D. | 达平衡后,升高温度,反应速率减慢 |
8.在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的数据是( )
| A. | v(A)=0.9 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=1.4 mol/(L•s) | D. | v(D)=1.8 mol/(L•s) |
15.已知25℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
| A. | 向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| C. | 温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 | |
| D. | 将AgCl加入到较浓的KI溶液中,AgCl能转化为AgI |
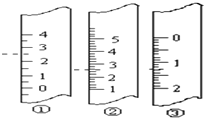 某同学用0.10mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
某同学用0.10mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下: