题目内容
15.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(1)△H1=-Q1 KJ/mol2H2(g)+O2(g)═2H2O(g)△H2=-Q2 KJ/mol
2H2(g)+O2(g)═2H2O(1)△H3=-Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是( )
| A. | 放出的热量为(0.4Q1+0.05Q3)KJ | B. | 放出的热量为(0.4Q1+0.05Q2)KJ | ||
| C. | △H2=△H3 | D. | △H2<△H3 |
分析 A.根据混合气体的体积计算混合气体的物质的量,结合气体体积比计算甲烷、氢气的物质的量,再根据热化学反应方程式计算放出的热量;
B.经完全燃烧后恢复至常温,水为液态;
C.H2O(g)→H2O(l)为放热过程,所以Q2<Q3,由于△H为负值,所以△H2>△H3;
D.H2O(g)→H2O(l)为放热过程,所以Q2<Q3,由于△H为负值,所以△H2>△H3.
解答 解:A.甲烷和氢气的混合气体11.2L(已折合成标准状况),
所以甲烷和氢气的混合气体的总的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
甲烷和氢气的体积比为4:1,
所以甲烷的物质的量为0.5mol×$\frac{4}{5}$=0.4mol,
氢气的物质的量为0.5mol-0.4mol=0.1mol.
由CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-Q1kJ/mol可知,
0.4mol甲烷燃烧放出的热量为0.4mol×Q1kJ/mol=0.4Q1kJ;
由2H2(g)+O2(g)═2H2O(l)△H=-Q3kJ/mol可知,
0.1mol氢气燃烧生成液态水放出的热量为0.1mol×$\frac{1}{2}$×Q3kJ/mol=0.05Q3kJ,
所以放出的热量为0.4Q1+0.05Q3,
故A正确;
B.经完全燃烧后恢复至常温,水为液态,氢气按2H2(g)+O2(g)═2H2O(l)△H=-Q3kJ/mol计算,故B错误;
C.H2O(g)→H2O(l)为放热过程,所以Q2<Q3,由于△H为负值,所以△H2>△H3,故C错误;
D.H2O(g)→H2O(l)为放热过程,所以Q2<Q3,由于△H为负值,所以△H2>△H3,故D错误;
故选A.
点评 本题考查根据热化学方程式计算反应热,注意根据水的状态选择相应的热化学方程式计算反应热为解答本题的关键,题目难度中等.

| A. | $\frac{b-2c}{a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-2c}{a}$ | D. | $\frac{2b-4c}{a}$ |
| A. | 浓硝酸、浓硫酸均能将木炭氧化成二氧化碳 | |
| B. | Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 | |
| C. | Li、C、S分别在足量氧气中燃烧均生成一种相应氧化物 | |
| D. | NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
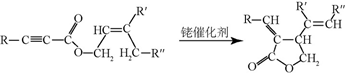
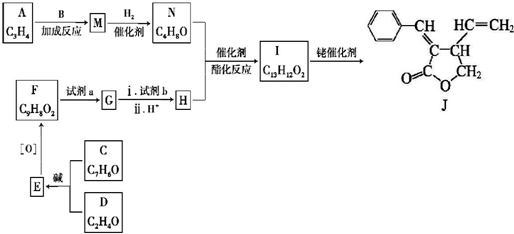
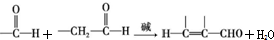
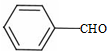 +CH3CHO$\stackrel{碱}{→}$
+CH3CHO$\stackrel{碱}{→}$ +H2O.
+H2O.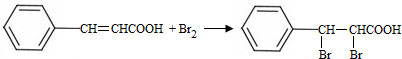 ;试剂b是NaOH、醇溶液.
;试剂b是NaOH、醇溶液.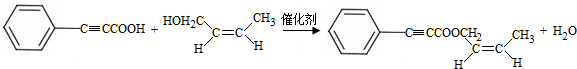 .
.