题目内容
7.为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置.(1)通过“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式是2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(2)在一定温度下,向1L密闭恒容容器中充入1molNO、2molCO,发生上述反应,10s时反应达平衡,此时CO的物质的量为1.2mol.请回答下列问题:
①前10s内平均反应速率v(CO)为0.08mol•L-1•s-1.
②在该温度下反应的平衡常数K=4.44
③关于上述反应,下列叙述正确的是CD(填编号)
A.平衡时,移走部分CO2,平衡将向右移动,正反应速率加块
B.扩大容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,则此时v正>v逆.
分析 (1)CO与NO反应,生成无毒气体为氮气和二氧化碳;
(2)①根据v=$\frac{△c}{△t}$计算出前10s内CO的平均反应速率;
②结合平衡三段式列式计算平衡浓度,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
③依据化学平衡移动原理分析选项,改变条件,平衡向减弱这种改变的方向进行.
解答 解:(1)由NO、CO相互反应转换成无毒的气体,即生成氮气和二氧化碳,该反应的化学反应方程式为2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(2)在一定温度下,向1L密闭容器中充入0.5mol NO、2mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6mol,依据化学平衡三段式列式计算:
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol) 1 2 0 0
变化量(mol) 0.8 0.8 0.4 0.8
平衡量(mol) 0.2 1.2 0.4 0.8
①前10s内平均反应速率v(CO)=$\frac{\frac{0.8mol}{1L}}{10s}$=0.08mol•L-1•s-1,
故答案为:0.08mol•L-1•s-1;
②体积为1L,物质的量数值为浓度数值,计算得到平衡常数K=$\frac{0.4×0.{8}^{2}}{0.{2}^{2}×1.{2}^{2}}$≈4.44,
故答案为:4.44;
③A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率减小,故A错误;
B.该反应是气体体积减小的反应,扩大容器的体积,压强减小,平衡将向左移动,故B错误;
C.催化剂对正逆反应速率影响程度相同,在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂,故C正确;
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4mol N2,浓度商Q=$\frac{0.8×0.{8}^{2}}{0.{2}^{2}×{2}^{2}}$=3.2<K=4.44,平衡正向进行,则此时v正>v逆 ,故D正确;
故答案为:CD.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学反应速率、平衡常数计算及化学平衡影响等知识,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的分析能力及化学计算能力.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案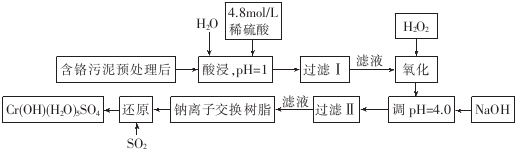
常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0 溶解) |
(2)调pH=4.0是为了除去Fe3+
(3)钠离子交换树脂的作用原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+、Al3+、Mg2+
(4)试配平下列氧化还原反应方程式:2Fe2++1H2O2+2H+═2Fe3++2H2O( )
(5)通入SO2的目的是将六价铬元素还原成三价铬元素,生成Cr(OH)(H2O)5SO4.
①过氧化钠 ②次氯酸 ③双氧水 ④活性炭 ⑤二氧化硫 ⑥臭氧.
| A. | ①②③⑤ | B. | 只有①②③⑥ | C. | ②③④⑤ | D. | 只有①③⑤⑥ |
2H2(g)+O2(g)═2H2O(g)△H2=-Q2 KJ/mol
2H2(g)+O2(g)═2H2O(1)△H3=-Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是( )
| A. | 放出的热量为(0.4Q1+0.05Q3)KJ | B. | 放出的热量为(0.4Q1+0.05Q2)KJ | ||
| C. | △H2=△H3 | D. | △H2<△H3 |
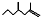 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),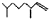 (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)3CH=CH-CH=CH(CH2)3CH3.下列说法正确的是( )
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)3CH=CH-CH=CH(CH2)3CH3.下列说法正确的是( )| A. | 以上三种信息素互为同系物 | |
| B. | 以上三种信息素均能使溴的四氯化碳溶液褪色 | |
| C. | 2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同分异构体 | |
| D. | 家蚕的性信息素与1molBr2加成产物只有一种 |
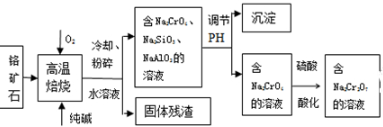
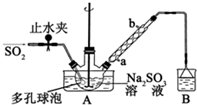 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图: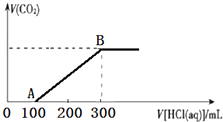 200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液.向上述所得溶液中,逐滴滴加2mol•L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
200mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液.向上述所得溶液中,逐滴滴加2mol•L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示: