题目内容
5.A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体.D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体.它们之间的转化如图所示(某些反应条件和部分反应产物已略去).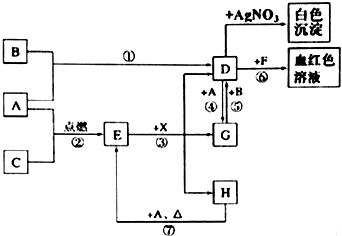
(1)在反应①~⑦中,不属于氧化还原反应的是③⑥(填编号).
(2)反应③的离子方程式为:Fe3O4+8H+=Fe2++2Fe3++4H2O;
(3)反应⑦的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;该反应中每消耗0.3mol的A,可转移电子0.8mol.
(4)除去D溶液中混有的少量G的方法是:向混合溶液中通入足量的氯气.
分析 A为固体,B为黄绿色气体,说明B为Cl2,D与F反应得到血红色溶液,结合转化关系可知,固体A为Fe,D为FeCl3,F为KSCN,由D与G之间的相互转化,可知G为FeCl2,Fe与无色气体C反应得到E,E与X反应得到D、G、H,且X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体,可推知C为O2,E为Fe3O4,X为HCl,H为H2O,据此解答.
解答 解:A为固体,B为黄绿色气体,说明B为Cl2,D与F反应得到血红色溶液,结合转化关系可知,固体A为Fe,D为FeCl3,F为KSCN,由D与G之间的相互转化,可知G为FeCl2,Fe与无色气体C反应得到E,E与X反应得到D、G、H,且X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体,可推知C为O2,E为Fe3O4,X为HCl,H为H2O,
(1)在反应①~⑦中,①为铁和氯气发生的氧化还原反应,②为铁和氧气发生的氧化还原反应,③为四氧化三铁和盐酸发生的复分解反应,不是氧化还原反应,④为氯化铁和铁发生的氧化还原反应,⑤为氯化亚铁和氯气发生的氧化还原反应,⑥是氯化铁和硫氰酸盐发生的复分解反应,不是氧化还原反应,
故答案为:③⑥;
(2)反应③的离子方程式是:Fe3O4+8H+=Fe2++2Fe3++4H2O,
故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O;
(3)反应⑦是铁在水蒸气中发生的反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;该反应中符合氧化还原反应的电子守恒,氢元素化合价从+1价变化为0价,4H2O反应转移电子为 8mol,铁元素从0价变化为+$\frac{8}{3}$价,每消耗 0.3mol的A(Fe),可转移电子0.8mol,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;0.8;
(4)除去FeCl3溶液中混有的少量FeCl2的方法是:向混合溶液中通入足量的氯气,
故答案为:向混合溶液中通入足量的氯气.
点评 本题考查无机物推断,涉及Fe、Cl元素化合物的性质与转化,物质的颜色是推断突破口,需要熟练掌握元素化合物知识,题目难度中等.

| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2.4g金属镁变为镁离子时所含电子数为NA | |
| B. | 1mol•L-1的A1Cl3溶液中,Cl-离子的数目为3NA | |
| C. | 标准状况下,22.4LSO3含有的分子数为NA | |
| D. | 常温常压下,16g O2和O3的混合气体所含分子数为NA |
| A. | NaH+H2O═NaOH+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2F2+2H2O═4HF+O2 |
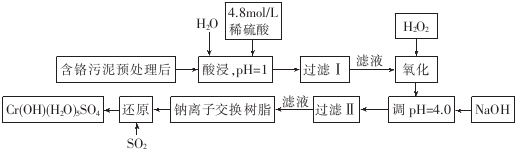
常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0 溶解) |
(2)调pH=4.0是为了除去Fe3+
(3)钠离子交换树脂的作用原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+、Al3+、Mg2+
(4)试配平下列氧化还原反应方程式:2Fe2++1H2O2+2H+═2Fe3++2H2O( )
(5)通入SO2的目的是将六价铬元素还原成三价铬元素,生成Cr(OH)(H2O)5SO4.
2H2(g)+O2(g)═2H2O(g)△H2=-Q2 KJ/mol
2H2(g)+O2(g)═2H2O(1)△H3=-Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是( )
| A. | 放出的热量为(0.4Q1+0.05Q3)KJ | B. | 放出的热量为(0.4Q1+0.05Q2)KJ | ||
| C. | △H2=△H3 | D. | △H2<△H3 |
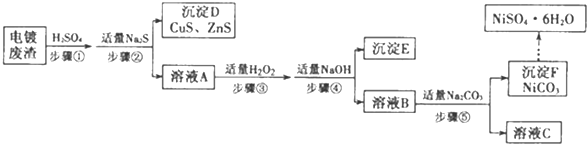
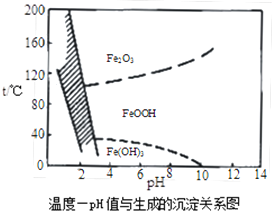
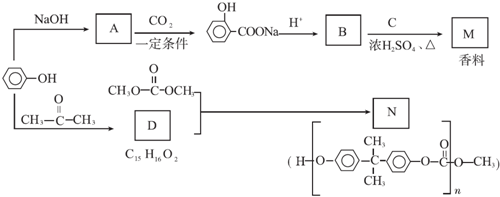
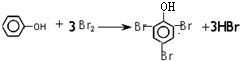 .
. ;
; +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$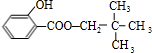 +H2O.
+H2O.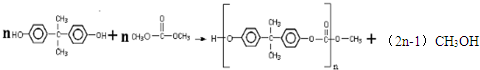 ,反应类型为缩聚反应.
,反应类型为缩聚反应.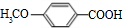 .
.