题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、在pH=1的溶液中:K+、Na+、SO42-、HCO3- | ||
B、在
| ||
| C、在0.1 mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | ||
| D、在0.1 mol?L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- |
考点:离子共存问题
专题:
分析:A.在pH=1的溶液中氢离子浓度为0.1mol/L,碳酸氢根离子与氢离子反应生成二氧化碳气体;
B.在
=10-12的溶液中氢氧根离子浓度为0.1mol/L,K+、Na+、ClO-、NO3-离子之间不发生反应,且都不与氢氧根离子反应;
C.铁离子与碘离子、硫氰根离子发生反应;
D.碳酸根离子与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体.
B.在
| c(H+) |
| c(OH-) |
C.铁离子与碘离子、硫氰根离子发生反应;
D.碳酸根离子与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体.
解答:
解:A.在pH=1的溶液为酸性溶液,溶液中存在大量氢离子,HCO3-与氢离子反应生成二氧化碳气体和水,在溶液中不能大量共存,故A错误;
B.在
=10-12的溶液中,根据水的离子积可知氢氧根离子浓度为0.1mol/L,K+、Na+、ClO-、NO3-离子之间不反应,且都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.I-、SCN-分别与铁离子发生氧化还原反应、络合反应,在溶液中不能大量共存,故C错误;
D.Al3+与碳酸钠溶液发生双水解反应,在溶液中不能大量共存,故D错误;
故选B.
B.在
| c(H+) |
| c(OH-) |
C.I-、SCN-分别与铁离子发生氧化还原反应、络合反应,在溶液中不能大量共存,故C错误;
D.Al3+与碳酸钠溶液发生双水解反应,在溶液中不能大量共存,故D错误;
故选B.
点评:本题考查离子共存的判断,该题是高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
用NA表示阿伏加德罗常数.下列说法中,正确的是( )
| A、2.0g超重水(3H2O)中含有的质子数为1.0 NA |
| B、84 gNaHCO3与MgCO3的混合物中所含氧原子数目为3NA |
| C、27gAl在 22.4L Cl2中燃烧,转移的电子总数为3 NA |
| D、60 g石英晶体中含有的Si-O键数目为2NA |
下列有关电解质的说法错误的是( )
| A、强电解质溶液的导电性不一定强于弱电解质溶液的导电性 |
| B、电解质溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数 |
| C、易溶物是强电解质,难溶物一定是弱电解质 |
| D、硫酸钡在水里的溶解度很小,但溶于水的硫酸钡全部电离,所以硫酸钡是强电解质 |
下列离子方程式与所述事实相符且正确的是( )
| A、用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I-═I2+2OH- |
| B、高锰酸钾与足量浓盐酸反应制氯气:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O |
| C、AlCl3溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、漂白粉溶液中,通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
能正确表示下列反应的离子方程式为( )
| A、碘化亚铁溶于稀硝酸中:3Fe2++4H++NO3-=3Fe3++NO↑+2 H2O | ||||
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | ||||
C、向沸水中滴入几滴饱和氯化铁溶液,并加热至溶液成红褐色:Fe3++3H2O
| ||||
| D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
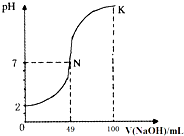 常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )| A、H2A为二元强酸 |
| B、K点时加水稀释溶液,c(H+)增大 |
| C、N点对应溶液有:c(Na+)=c(A2-)+c(HA-) |
| D、K点对应溶液中离子浓度由大到小的顺序为:c(A2-)>c(Na+)>c(OH-)>c(H+) |
