题目内容
17.A、B、C、D、E、F代表6种元素.请填写下列空白.(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为N.
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与Ar相同,B的元素符号为Cl,C的元素符号为K.
(3)D元素的正三价离子的3d轨道为半充满,D的元素符号为Fe,其基态原子的电子排布式为1s22s22p63s23p63d64s2.
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为Cu,其基态原子的电子排布式为1s22s22p63s23p63d104s1.
(5)F元素的基态原子的外围电子排布式为3d54s2,其原子结构示意图为
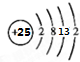 ,其最高正价为+7;位于元素周期表中第四周期ⅦB族.
,其最高正价为+7;位于元素周期表中第四周期ⅦB族.
分析 (1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,原子只能有2个电子层,核外电子排布式为1s22s22p3;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与Ar相同,则B为氯、C为钾;
(3)D元素的正三价离子的3d轨道为半充满,D元素原子外围电子排布为3d64s2,D为Fe;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,原子核外电子数目为2+8+18+1=29,故E为Cu元素;
(5)F元素的基态原子的外围电子排布式为3d54s2,最高正化合价为+7,位于元素周期表中第四周期ⅦB族.
解答 解:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,原子只能有2个电子层,核外电子排布式为1s22s22p3,为N元素,故答案为:N;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与Ar相同,则B为Cl、C为K,故答案为:Cl;K;
(3)D元素的正三价离子的3d轨道为半充满,D元素原子外围电子排布为3d64s2,D为Fe,其基态原子的电子排布式为1s22s22p63s23p63d64s2,故答案为:Fe;1s22s22p63s23p63d64s2;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,原子核外电子数目为2+8+18+1=29,故E为Cu元素,原子核外电子排布式为:1s22s22p63s23p63d104s1,故答案为:Cu;1s22s22p63s23p63d104s1;
(5)F元素的基态原子的外围电子排布式为3d54s2,原子结构示意图为 ,最高正化合价为+7,位于元素周期表中第四周期ⅦB族,故答案为:
,最高正化合价为+7,位于元素周期表中第四周期ⅦB族,故答案为: ;+7;四、ⅦB.
;+7;四、ⅦB.
点评 本题考查核外电子排布规律知识,比较基础,关键是对核外电子规律的理解掌握,注意构造原理、泡利原理与洪特规则.

 名校课堂系列答案
名校课堂系列答案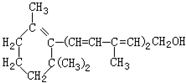
下列关于该化合物的说法正确的是( )
| A. | 维生素A的分子式为C16H25O | |
| B. | 维生素A含有苯环结构 | |
| C. | 维生素A的一个分子中有3个双键 | |
| D. | 维生素A的分子中含有两种官能团 (维生素A的结构简式) |
| A. | 第ⅢB族元素种类最多 | |
| B. | 只有第3列到第12列全部是金属元素 | |
| C. | 周期数大于或等于族的序数时,一定是金属元素 | |
| D. | 是按原子的质量数由小到大的顺序编制的 |
| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 1:2 |
| A. | Cl2 | B. | Na+ | C. | Cu2+ | D. | Mg2+ |
| A. | 25℃时,加水稀释后,n(H+)•n(OH-)的乘积不变 | |
| B. | 离子浓度关系:3c(Fe3+)+c(NH4+)+c(H+)=c(OH-)+2c(SO42-) | |
| C. | 溶液呈酸性是因为NH4++H2O?NH3H2O+H+ | |
| D. | 温度升高(假设溶液的体积没有变化)溶液的pH增大 |
| A. | 0.25mol/L | B. | 0.44mol/L | C. | 0.5mol/L | D. | 0.8mol/L |
| A. | 碳酸钠(Na2CO3) | B. | 醋酸(CH3COOH) | C. | 乙炔 | D. | 四氯化碳(CCl4) |