题目内容
5.由12C16O和14C16O组成的混合气体对氦气(相对原子质量为4)的相对密度为7.125,则混合气体中14C和12C的原子个数比为( )| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 1:2 |
分析 相同条件下,两种气体的密度之比等于其相对分子质量之比,设12C16O和14C16O的物质的量分别为xmol、ymol,再根据平均摩尔质量M=$\frac{m}{n}$计算二者物质的量之比,进而计算混合气体中12C和14C的原子个数比.
解答 解:相同条件下,两种气体的密度之比等于其相对分子质量之比,所以由12CO和14CO组成的混合气体的平均摩尔质量为7.125×4g/mol=28.5g/mol,
设12C16O和14C16O的物质的量分别为xmol、ymol,则:
$\frac{28x+30y}{x+y}$=28.5,解得:x:y=3:1,
则混合气体中14C和12C的原子个数比为1:3,
故选:B.
点评 本题考查物质的量有关计算,关键是计算平均摩尔质量,注意对阿伏伽德罗定律及其推论的理解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列说法或有关化学用语的表达正确的是( )
| A. | 第一电离能介于B、N之间的第二周期元素有1种 | |
| B. | 基态Fe原子的外围电子排布图为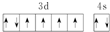 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 根据原子核外电子排布的特点,Cu在元素周期表中位于s区 |
13.下列“类推”合理的是( )
| A. | 加热CS2CO3可生成CS2O和CO2(CS:铯 IA) | |
| B. | 铊(Tl)与铝同族,其单质既能与HCl又能与NaOH溶液反应 | |
| C. | AgAt为白色沉淀,不溶于稀HNO3(At:砹 VⅡA) | |
| D. | Ra(OH)2是易溶于水的强碱(Ra:镭ⅡA) |
10.某反应过程能量变化如图所示,下列说法正确的是( )
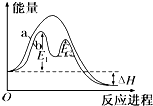

| A. | 改变催化剂,可改变该反应的活化能 | |
| B. | 该反应为吸热反应,热效应等于△H | |
| C. | 反应过程a有催化剂参与 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
14.下列实验操作和结论错误的是( )
| A. | 用新制Cu(OH)2可鉴别麦芽糖和蔗糖 | |
| B. | 用银镜反应可证明淀粉是否转化为葡萄糖,但不能证明是否完全转化 | |
| C. | 浓H2SO4可使蔗糖脱水变黑,证明蔗糖含C,H,O三种元素 | |
| D. | 蔗糖溶液中滴加几滴稀H2SO4后,水溶加热几分钟,加入到银氨溶液中,不能发生银镜反应,证明蔗糖不水解 |
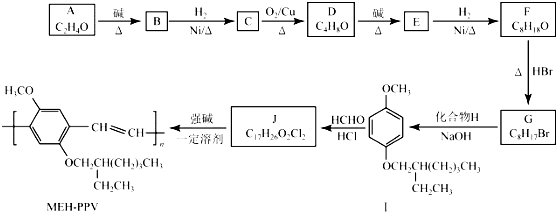
 +H2O (R、R′表示烃基或氢)
+H2O (R、R′表示烃基或氢) (R、R′表示烃基烷氧基)
(R、R′表示烃基烷氧基)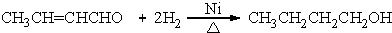 .
.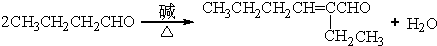 .
.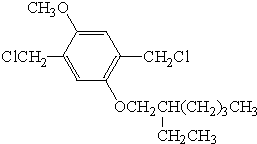 .
.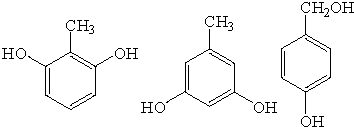 .
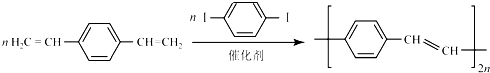
.
 、
、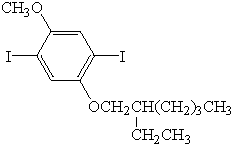 .
.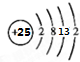 ,其最高正价为+7;位于元素周期表中第四周期ⅦB族.
,其最高正价为+7;位于元素周期表中第四周期ⅦB族. ;
;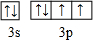 .
.