题目内容
11.某些金属卤化物可跟其卤素单质反应,如KI+I2?KI3(KI3易溶于水).下列推断错误的是( )| A. | I3-溶液中存在如下平衡:I3-?I2+I- | |
| B. | 在KI3溶液中加入AgNO3溶液,会析出AgI3沉淀 | |
| C. | 向KI3溶液中通入Cl2,溶液颜色会加深 | |
| D. | 配制碘水时,加入KI可增大I2的溶解度 |
分析 根据KI+I2?KI3可知,在KI3溶液中存在I3-、I-、I2等粒子,I-+I2?I3-结合对应的物质的性质以及平衡移动的影响因素解答该题.
解答 解:A.由反应KI+I2?KI3可知,溶液中存在平衡I3-?I-+I2,故A不符合;
B.在KI3溶液中存在I-,加入AgNO3溶液,会析出AgI沉淀,故B符合;
C.在KI3溶液中存在I-,通入Cl2,氧化碘离子为碘单质,溶液颜色会加深,故C不符合;
D.从平衡移动的角度分析,对于平衡I3-?I-+I2,增加I-浓度,平衡向生成I3-的方向移动,可增大I2的溶解度,故D不符合,
故选B.
点评 本题考查氯溴碘及其化合物的综合应用,题目难度中等,本题注意根据可逆反应的特点解答该题.

练习册系列答案
相关题目
1.能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是( )
| A. | 用Cu作阴、阳电极,电解CuCl2溶液 | |
| B. | 用Cu作阴、阳电极,电解K2SO4溶液 | |
| C. | 铜锌合金在潮湿空气中发生电化学腐蚀 | |
| D. | Cu作原电池的负极,碳棒作正极,NaCl溶液作电解质溶液 |
2.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA | |
| B. | NA个D2O分子中,含有10NA个电子 | |
| C. | 117克氯化钠固体中,含有2NA个氯化钠分子 | |
| D. | 32克SO2与足量的O2反应转移的电子数为NA |
6.下列说法正确的是( )
| A. | 过量SO2通入NaOH溶液中发生SO2+2OH-═SO32-反应 | |
| B. | BF3分子中所有原子都满足最外层8电子结构 | |
| C. | 某元素原子的最外层只有2个电子,则该元素一定是ⅡA族元素 | |
| D. | 使品红溶液褪色,加热后又出现红色的实验能证明SO2气体的存在 |
16.X~R是元素周期表中的短周期元素,其性质或结构信息如表:
请回答下列问题:
(1)X在元素周期表中的位置是第三周期ⅦA族
(2)元素W的离子结构示意图为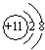
(3)元素R的最高价氧化物的电子式为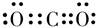
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型为离子键、极性键
(5)含Y的某化合物的水溶液呈酸性,可净水.起净水作用的物质为Al(OH)3胶体
(6)W的氢氧化物是重要的基本化工原料.
工业上用电解饱和NaCl溶液制取该氢氧化物,生产中副产物有C12、H2 (写化学式)
| 元素 | X | Y | Z | W | R |
| 性质信息 | 能形成+7价的化合物 | 日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子 | 焰色反应为黄色 | 位于第IVA,是形成化合物种类最多的元素 |
(1)X在元素周期表中的位置是第三周期ⅦA族
(2)元素W的离子结构示意图为
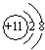
(3)元素R的最高价氧化物的电子式为
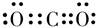
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型为离子键、极性键
(5)含Y的某化合物的水溶液呈酸性,可净水.起净水作用的物质为Al(OH)3胶体
(6)W的氢氧化物是重要的基本化工原料.
工业上用电解饱和NaCl溶液制取该氢氧化物,生产中副产物有C12、H2 (写化学式)
3.下列溶液中能够区别SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④品红溶液.
①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④品红溶液.
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |