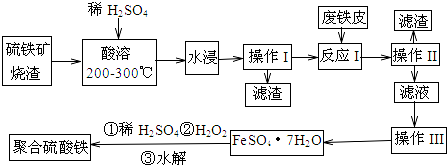
题目内容
1.在某澄清溶液中,可能存在下列几种离子:H+、K+、Ba2+、SO42-、I-、CO32-.取该溶液进行下列实验:①用pH试纸检验,该溶液呈强酸性;②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色;③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成.(1)根据上述实验现象,推断原溶液中肯定存在的离子是H+、I-、Ba2+,肯定不存在的离子是CO32-、SO42-,可能存在的离子是K+.
(2)若步骤②中消耗0.1molCl2,则溶液中与Cl2反应的离子的物质的量浓度为1mol/L.
(3)写出实验③中生成白色沉淀的离子方程式:CO32-+Ba2+=BaCO3↓.
分析 ①溶液呈强酸性,说明溶液中肯定含有H+,与H+发生反应的不能共存;
②CCl4层呈紫红色,说明有I2,说明原溶液中含有I-,而I-与Fe3+发生反应而不能共存;
③取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,说明溶液中肯定含有Ba2+,而Ba2+能与SO42-产生沉淀,说明溶液中不含SO42-,以此解答该题.
解答 解:①溶液呈强酸性,说明溶液中肯定含有H+,与H+发生反应的不能共存;
②CCl4层呈紫红色,说明有I2,说明原溶液中含有I-,而I-与Fe3+发生反应而不能共存;
③取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,说明溶液中肯定含有Ba2+,而Ba2+能与SO42-产生沉淀,说明溶液中不含SO42-,
(1)根据上述实验现象,推断原溶液中肯定存在的离子是H+、I-、Ba2+,肯定不存在的离子是CO32-、SO42-,可能存在的离子是K+,
故答案为:H+、I-、Ba2+;CO32-、SO42-;K+;
(2)CCl4层呈紫红色,反应的离子方程式为2I-+Cl2=I2+2Cl-,消耗0.1molCl2,则I-为0.2mol,溶液体积为200mL,则浓度为$\frac{0.2mol}{0.2L}$=1mol/L,
故答案为:1mol/L;
(3)验③中生成白色沉淀为碳酸钡,反应的离子方程式为CO32-+Ba2+=BaCO3↓,故答案为:CO32-+Ba2+=BaCO3↓.
点评 本题考查了常见的离子检验方法,为高考常见题型,题目难度中等,涉及的离子之间的反应较多,注意根据有关离子间的反应和现象分析,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
11.某些金属卤化物可跟其卤素单质反应,如KI+I2?KI3(KI3易溶于水).下列推断错误的是( )
| A. | I3-溶液中存在如下平衡:I3-?I2+I- | |
| B. | 在KI3溶液中加入AgNO3溶液,会析出AgI3沉淀 | |
| C. | 向KI3溶液中通入Cl2,溶液颜色会加深 | |
| D. | 配制碘水时,加入KI可增大I2的溶解度 |
12.硅及其化合物在生产生活中应用广泛,下列说法错误的是( )
| A. | 水泥是建筑工业的基础材料,可用黏土、石灰石等原料来制得 | |
| B. | 常温下,二氧化硅可与NaOH溶液反应 | |
| C. | 向硅酸钠溶液中滴加稀盐酸,溶液中不会出现沉淀 | |
| D. | 晶体硅是良好的半导体材料 |
9.1mol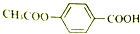 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )| A. | 2mol | B. | 3mol | C. | 4mol | D. | 5mol |
16.将0.2molCO2通入装有足量Na2O2的干燥管中,干燥管增重的质量为( )
| A. | 2.8g | B. | 5.6g | C. | 8.8g | D. | 11.2g |
6.已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系正确的是( )
| A. | 4 v(NH3)=5 v(O2) | B. | 5v(O2)=6 v(H2O) | C. | 2 v(NH3)=3 v(H2O) | D. | 4v(O2)=5 v(NO) |
13.如图是温度和压强对反应X+Y?2Z影响的示意图.下列叙述正确的是( )
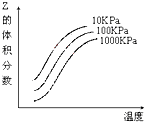

| A. | 上述可逆反应的正反应为放热反应 | B. | X、Y、Z均为气态 | ||
| C. | X和Y中只有一种是气态,Z为气态 | D. | 上述反应的正反应的△H>0 |
11.下列有关物质性质或应用的说法中不正确的是( )
| A. | 自来水厂可用明矾作净水剂 | |
| B. | 二氧化硅既能与氢氟酸反应又能与氢氧化钠溶液反应,所以二氧化硅是两性氧化物 | |
| C. | 丁达尔效应是区分胶体与溶液的一种常用方法 | |
| D. | MgO、Al2O3熔点高,可用于制作耐火材料 |