题目内容
3.下列溶液中能够区别SO2和CO2气体的是( )①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④品红溶液.
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
分析 SO2具有还原性、弱氧化性和漂白性,SO2和CO2气体都可使澄清石灰水变浑浊,以此选择鉴别方法.
解答 解:①SO2和CO2气体都可使澄清石灰水变浑浊,无法鉴别,故错误;
②二氧化硫和硫化氢和发生氧化还原反应生成硫,溶液变浑浊,可鉴别,故正确;
③酸性高锰酸钾溶液具有强氧化性,可与二氧化硫发生氧化还原反应,可鉴别,故正确;
④SO2具有漂白性,可使品红褪色,可鉴别,故正确.
故选C.
点评 本题考查物质的检验和鉴别,为高频考点,把握物质的性质、性质差异及发生的反应与现象等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
13.某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O  Fe(OH)2+2Ni(OH)2下列推断中不正确的是( )
Fe(OH)2+2Ni(OH)2下列推断中不正确的是( )
①放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是Fe(OH)2+2e-═Fe+2OH-
③充电时,Ni(OH)2为阳极
④蓄电池的电极必须是浸在某种碱性电解质溶液中.
 Fe(OH)2+2Ni(OH)2下列推断中不正确的是( )
Fe(OH)2+2Ni(OH)2下列推断中不正确的是( )①放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是Fe(OH)2+2e-═Fe+2OH-
③充电时,Ni(OH)2为阳极
④蓄电池的电极必须是浸在某种碱性电解质溶液中.
| A. | ① | B. | ①②④ | C. | ①③④ | D. | ②③④ |
14.下列表述中,正确的是( )
| A. | 常温下,0.1mol•L-1的醋酸钠溶液中,c2(H+)=Kw-c(CH3COOH)•c(H+) | |
| B. | 常温下,各为0.1mol•L-1的NaHCO3和Na2CO3的混合溶液中:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 向氨水中滴加适量的盐酸呈酸性时,不可能有c(Cl-)>c(H+)=c(NH4+)>c(OH-) | |
| D. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
11.某些金属卤化物可跟其卤素单质反应,如KI+I2?KI3(KI3易溶于水).下列推断错误的是( )
| A. | I3-溶液中存在如下平衡:I3-?I2+I- | |
| B. | 在KI3溶液中加入AgNO3溶液,会析出AgI3沉淀 | |
| C. | 向KI3溶液中通入Cl2,溶液颜色会加深 | |
| D. | 配制碘水时,加入KI可增大I2的溶解度 |
18.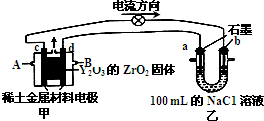 已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ/mol
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+659.8 kJ/mol
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图所示装置中,以稀土金属材料为惰性电极,在两极上分别通入甲烷和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-.请回答下列问题:
①d电极上的反应式为CH4-8e-+4O2-=CO2+2H2O
②图乙是电解100mL 0.5mol/L的NaC1溶液,若a电极上产生112mL(标准状况)气体,则所得溶液的pH=13(不考虑溶液体积的变化).
(3)将一定量纯净的氨基甲酸铵置于真空密闭容器中(假设容器体积不变,固态试样体积忽略不计),在恒定的温度下使其分解达到平衡:
H2NCOONH4(s)═2NH3(g)+CO2(g).实验测得不同温度下的数据如表:
①氨基甲酸铵分解反应的焓变△H>0(填“>”、“<”或“=”).
②可以判断该分解反应已经达到化学平衡的是BC(填序号).
A.2υ(NH3)=υ(CO2) B.密闭容器中气体总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25℃时氨基甲酸铵的分解平衡常数为1.64×10-8(mol/L)3(保留两位小数).
(4)25℃时,NH3•H2O电离常数K=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,在某MgC12溶液中加入一定量的某浓度的氨水后,测得混合液pH=11,计算此温度下残留在溶液中的c(Mg2+)=1.8×10-5mol/L.
 已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ/mol
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+659.8 kJ/mol
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天.如图所示装置中,以稀土金属材料为惰性电极,在两极上分别通入甲烷和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-.请回答下列问题:
①d电极上的反应式为CH4-8e-+4O2-=CO2+2H2O
②图乙是电解100mL 0.5mol/L的NaC1溶液,若a电极上产生112mL(标准状况)气体,则所得溶液的pH=13(不考虑溶液体积的变化).
(3)将一定量纯净的氨基甲酸铵置于真空密闭容器中(假设容器体积不变,固态试样体积忽略不计),在恒定的温度下使其分解达到平衡:
H2NCOONH4(s)═2NH3(g)+CO2(g).实验测得不同温度下的数据如表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
②可以判断该分解反应已经达到化学平衡的是BC(填序号).
A.2υ(NH3)=υ(CO2) B.密闭容器中气体总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25℃时氨基甲酸铵的分解平衡常数为1.64×10-8(mol/L)3(保留两位小数).
(4)25℃时,NH3•H2O电离常数K=1.8×10-5,Mg(OH)2的溶度积常数Ksp=1.8×10-11,在某MgC12溶液中加入一定量的某浓度的氨水后,测得混合液pH=11,计算此温度下残留在溶液中的c(Mg2+)=1.8×10-5mol/L.
8.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 18g水中所含的电子数为8NA | |
| B. | 常温常压下,28g氮气所含的原子数为2NA | |
| C. | 0.5molCuO的摩尔质量为40g/mol | |
| D. | 22.4L甲烷(CH4)所含的原子数为5NA |
12.硅及其化合物在生产生活中应用广泛,下列说法错误的是( )
| A. | 水泥是建筑工业的基础材料,可用黏土、石灰石等原料来制得 | |
| B. | 常温下,二氧化硅可与NaOH溶液反应 | |
| C. | 向硅酸钠溶液中滴加稀盐酸,溶液中不会出现沉淀 | |
| D. | 晶体硅是良好的半导体材料 |
13.如图是温度和压强对反应X+Y?2Z影响的示意图.下列叙述正确的是( )
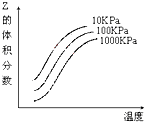

| A. | 上述可逆反应的正反应为放热反应 | B. | X、Y、Z均为气态 | ||
| C. | X和Y中只有一种是气态,Z为气态 | D. | 上述反应的正反应的△H>0 |