题目内容
13.A、B、C、D、E是五种前四周期的主族元素,它们的原子序数依次增大;A元素的单质气体标况下密度为0.0899g/L;C与A同主族,且与D同周期;D元素原子的最外层电子数比次外层电子数少2;A、C、D这三种元素,每一种与B元素都能形成原子个数比不相同的若干种化合物;E的氧化物、氯化物都是实验室常用的干燥剂.请回答:(1)实验室制取A单质气体的化学方程式为Zn+H2SO4=ZnSO4+H2↑
(2)B和D两种元素相比较,原子得电子能力较强的元素在周期表中的位置为第二周期第ⅥA族以下三种说法中,可以验证B和D得电子能力强弱的是(填写编号)bc
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,B元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)E元素原子的结构示意图为
 ;用E的氧化物和氯化物都能干燥的气体有d
;用E的氧化物和氯化物都能干燥的气体有dA.CO2 b.Cl2 c.NH3 d.O2
(4)含E元素的某种盐可以做漂白剂,实验室保存该盐的方法是密封保存
(5)A、B、C、D可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为HSO3-+H+=SO2↑+H2O.
分析 A、B、C、D、E是五种前四周期的主族元素,它们的原子序数依次增大;A元素的单质气体标况下密度为0.0899g/L,A的摩尔质量为224L/mol×0.0899g/L=2g/mol,则A为H元素;D元素原子的最外层电子数比次外层电子数少2,则D为S;C与A同主族,且与D同周期,可知C为Na元素;A、C、D这三种元素,每一种与B元素都能形成原子个数比不相同的若干种化合物,可知B为O元素;E的氧化物、氯化物都是实验室常用的干燥剂,E为Ca,以此来解答.
解答 解:A、B、C、D、E是五种前四周期的主族元素,它们的原子序数依次增大;A元素的单质气体标况下密度为0.0899g/L,A的摩尔质量为224L/mol×0.0899g/L=2g/mol,则A为H元素;D元素原子的最外层电子数比次外层电子数少2,则D为S;C与A同主族,且与D同周期,可知C为Na元素;A、C、D这三种元素,每一种与B元素都能形成原子个数比不相同的若干种化合物,可知B为O元素;E的氧化物、氯化物都是实验室常用的干燥剂,E为Ca,
(1)实验室制取A单质气体的化学方程式为Zn+H2SO4=ZnSO4+H2↑,故答案为:Zn+H2SO4=ZnSO4+H2↑;
(2)B和D两种元素相比较,原子得电子能力较强的元素为O,在周期表中的位置为第二周期第ⅥA族,
a.比较这两种元素的常见单质的沸点,与非金属性无关,故不选;
b.二者形成的化合物中,B元素的原子显负价,可知B的非金属性强,故选;
c.比较这两种元素的气态氢化物的稳定性,可知氢化物稳定的对应元素的非金属性强,故选;
故答案为:第二周期第ⅥA族;bc;
(3)Ca元素原子的结构示意图为 ,用E的氧化物和氯化物都能干燥的气体有中性气体,如氧气,CaO不能干燥氯气、二氧化碳,氯化钙不能干燥氨气,故答案为:
,用E的氧化物和氯化物都能干燥的气体有中性气体,如氧气,CaO不能干燥氯气、二氧化碳,氯化钙不能干燥氨气,故答案为: ;d;
;d;
(4)含E元素的某种盐可以做漂白剂,与空气中的水、二氧化碳反应后生成HClO,HClO光照分解而变质,则实验室保存该盐的方法是密封保存,
故答案为:密封保存;
(5)A、B、C、D可形成两种酸式盐(均含有该四种元素):NaHSO3、NaHSO4,这两种酸式盐在水溶液中相互反应的离子方程式为HSO3-+H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O.
点评 本题考查原子结构与周期律,为高频考点,把握原子结构、元素周期律、元素化合物知识推断元素为解答的关键,注意元素的性质及单质、化合物的性质,侧重分析与应用能力的考查,题目难度中等.

 快捷英语周周练系列答案
快捷英语周周练系列答案| A. | 水污染的程度是由其溶氧量来测定 | |
| B. | 污染水的金属元素如汞、镉、铅等的含量极少时,不会对生物造成伤害 | |
| C. | 使用含磷洗衣粉会造成河水、湖水污染,使海藻疯狂生长,鱼类死亡 | |
| D. | 工业所排出的废水危害水生生物 |
| N | O | F |
| P | S | Cl |
(2)N、P两种元素的最高价氧化物对应的水化物的酸性:HNO3>H3PO4(填“>”、“=”或“<”).
(3)O位于元素周期表中的第二周期ⅥA族族.
(4)S、Cl两种元素氢化物的稳定性:H2S<HCl(填“>”、“=”或“<”).
| A. | 酸性:HXO4<H2Y O4<H3ZO4 | B. | 气态氢化物的稳定性:X<Y<Z | ||
| C. | 非金属性:X>Y>Z | D. | 元素负化合价的绝对值:X>Y>Z |
| A. | 除去N2中的少量O2,可通过灼热的Cu网后,收集气体 | |
| B. | 除去FeCl3溶液中Fe(OH)3沉淀可以过滤 | |
| C. | 除去乙醇中的少量NaCl,可用蒸馏的方法 | |
| D. | 重结晶不能用于提纯物质 |
【提出问题】将金属钠投入到硫酸铜溶液中,结果会怎样?
【查找资料】(1)少量钠通常保存在煤油中
(2)钠是银白色的软金属,可用小刀切割,熔点97.81℃,沸点882.9℃,密度为0.97g/cm3
(3)钠是一种很活泼的金属,遇水发生剧烈反应,2Na+2H2O=2NaOH+H2↑
【做出猜想】猜想Ⅰ:放出气体,生成蓝色沉淀,能置换出铜;
猜想Ⅱ:放出气体,生成蓝色沉淀,不能置换出铜.
【实验探究】
| 实验操作 | 实验现象 |
| ①取10ml一定溶质质量分数的硫酸铜溶液,倒入50ml的烧杯里 ②取一块钠,用滤纸吸干表面煤油,再切取绿豆大小的一块,投入溶液中 | 钠浮在液面上,熔化成闪亮小球,钠球游动,发出“嘶嘶”的声响,析出蓝色沉淀 |
(2)钠球游动,发出“嘶嘶”声响说明有气体产生.
(3)析出蓝色沉淀是因为2Na+2H2O=2NaOH+H2↑,2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 (用化学方程式表示).
【继续探究】有部分同学认为置换出的铜可能被蓝色沉淀掩盖,于是他们进一步探究:
| 实验操作 | 实验现象 | 结论 |
| 取烧杯中少许沉淀于试管中,再向其中加入过量的稀硫酸 | 沉淀全部溶解,溶液变蓝色 | 说明沉淀中不含红色的铜 |
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 | |
| C. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 实验室用排饱和食盐水法收集氯气 | |
| C. | 合成氨工业常采用Pt~Rh合金作为催化剂 | |
| D. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 |
 ,B的结构式为
,B的结构式为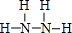 .
.