题目内容
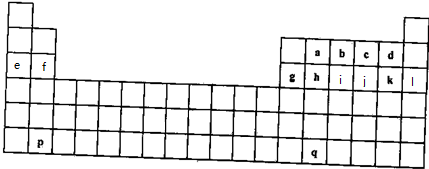
4.如图为部分元素在元素周期表中的相对位置.据此回答相关问题:| N | O | F |
| P | S | Cl |
(2)N、P两种元素的最高价氧化物对应的水化物的酸性:HNO3>H3PO4(填“>”、“=”或“<”).
(3)O位于元素周期表中的第二周期ⅥA族族.
(4)S、Cl两种元素氢化物的稳定性:H2S<HCl(填“>”、“=”或“<”).
分析 (1)同主族从上到下非金属性减弱,同周期从左向右非金属性增强;
(2)非金属性越强,对应最高价氧化物对应的水化物的酸性越强;
(3)原子结构决定元素的位置;
(4)非金属性越强,对应氢化物的稳定性越弱.
解答 解:(1)同主族从上到下非金属性减弱,同周期从左向右非金属性增强,则其中非金属性最强的是F,故答案为:F;
(2)非金属性N>P,对应最高价氧化物对应的水化物的酸性为HNO3>H3PO4,故答案为:>;
(3)O的最外层电子数为6,电子层数为2,则O位于元素周期表中的第二周期ⅥA族,故答案为:二周期ⅥA族;
(4)非金属性Cl>S,氢化物的稳定性:H2S<HCl,故答案为:<.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
9.化学是一门以实验为基础的自然科学,通过实验可以得知物质的组成、结构、性质及其变化规律.下列通过实验得出的结论正确的是( )
| A. | 天然气能在氧气中燃烧,说明氧气具有可燃性 | |
| B. | 水通电分解时生成氢气和氧气,说明水是由氢气和氧气组成 | |
| C. | 将石蕊试液滴入稀硫酸中溶液显红色,说明石蕊试液能使酸变红 | |
| D. | 通过在显微镜下观察木炭,得知木炭具有疏松多孔的结构 |
16.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| B. | 存在Fe2+的溶液中:Mg2+、SO42-、ClO-、Na+ | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 高锰酸钾溶液:H+、Na+、SO42-、葡萄糖分子 |
14.实验室现有足量的20%的NaOH溶液和蒸馏水,欲配制10%的NaOH溶液l00g,需要20%的NaOH溶液( )
| A. | 95g | B. | 10g | C. | 50g | D. | 100g |
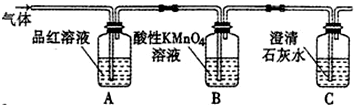
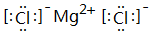 ,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.
,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.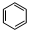 +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$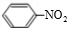 +H2O.
+H2O.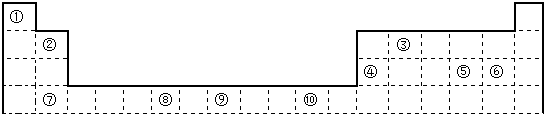
 .
. ;⑥和⑦形成的化合物电子式为
;⑥和⑦形成的化合物电子式为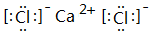 .③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.
.③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.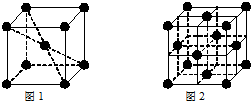
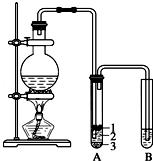 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: ;用E的氧化物和氯化物都能干燥的气体有d
;用E的氧化物和氯化物都能干燥的气体有d