题目内容
2.下列措施或事实不能用勒夏特列原理解释的是( )| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 实验室用排饱和食盐水法收集氯气 | |
| C. | 合成氨工业常采用Pt~Rh合金作为催化剂 | |
| D. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 |
分析 只有可逆反应,才存在平衡状态,只有存在平衡状态,才有平衡移动,只有存在平衡移动,才能够用勒夏特列原理解释.
解答 解:A、氯水中存在平衡Cl2+H2O?HClO+H++Cl-,光照HClO分解,溶液中HClO浓度降低,平衡向生成HClO方向移动,可用勒夏特列原理解释,可以用勒夏特列原理解释,故A不选;
B、氯气能够溶于水,存在Cl2+H2O?HClO+H++Cl-,食盐水中含有大量氯离子,促使平衡逆向移动,降低氯气在食盐水中的溶解度,可以用勒夏特列原理解释,故B不选;
C、采用合适的催化剂只影响反应速率,和化学平衡无关,不能用勒夏特列原理解释,故C选;
D、增大空气的量,平衡向正反应方向移动,所以可以用平衡移动原理解释,故D不选;
故选C.
点评 本题考查了勒夏特利原理、平衡移动等,难度中等,注意勒夏特列原理只可以解释平衡移动的相关问题.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
10.下列六种有机物:①2-甲基丁烷 ②2,2-二甲基丙烷 ③丙烷 ④戊烷 ⑤2-甲基丙烷 ⑥乙醇,按它们的沸点由高到低的顺序排列为( )
| A. | ①②③④⑤⑥ | B. | ②③④⑤⑥① | C. | ④⑤⑥②①③ | D. | ⑥④①②⑤③ |
17.下列各组离子在水溶液中一定能大量共存的是( )
| A. | 无色溶液:Al3+、NH4+、Cl-、HCO3- | |
| B. | 使紫色石蕊试纸变红色的溶液:Cl-、NO3-、Fe2+、K+ | |
| C. | 常温下,pH=13的溶液:K+、CO32-、Na+ | |
| D. | c(H+)=0.1mol/L的溶液:CO32-、Na+、HCO3-、Cl- |
7.下列物质在光照条件下与氯气反应时,生成的二氯代物种类最多的是( )
| A. | 乙烷 | B. | 丙烷 | C. | 新戊烷 | D. | 异丁烷 |
14.实验室现有足量的20%的NaOH溶液和蒸馏水,欲配制10%的NaOH溶液l00g,需要20%的NaOH溶液( )
| A. | 95g | B. | 10g | C. | 50g | D. | 100g |
11.下列反应的离子方程式正确的是( )
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ | |
| B. | 铁粉加入三氯化铁溶液中:2Fe+Fe3+=3Fe2+ | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O | |
| D. | FeCl2溶液中加入氯水:Cl2+2 Fe2+=2 Fe3++2Cl- |
12.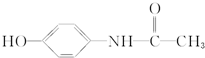 百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如下,下列有关该有机物的叙述正确的是( )
百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如下,下列有关该有机物的叙述正确的是( )
 百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如下,下列有关该有机物的叙述正确的是( )
百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如下,下列有关该有机物的叙述正确的是( )| A. | 分子式为C8H10NO2 | |
| B. | 该有机物属于α-氨基酸 | |
| C. | 该有机物属于α-氨基酸的同分异构体有3种 | |
| D. | 该有机物与FeCl3溶液发生显色反应 |
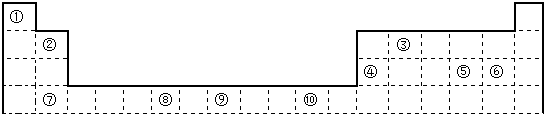
 .
. ;⑥和⑦形成的化合物电子式为
;⑥和⑦形成的化合物电子式为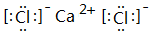 .③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.
.③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.
 ;用E的氧化物和氯化物都能干燥的气体有d
;用E的氧化物和氯化物都能干燥的气体有d