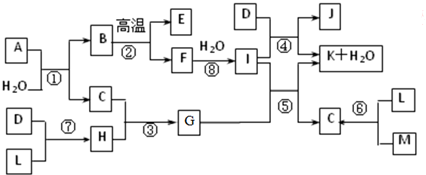
��Ŀ����
3��X��Y��Z��L��M����Ԫ�ص�ԭ��������������X��Y��Z��L����ɵ����ʵĻ���Ԫ�أ�M�ǵؿ��к�����ߵĽ���Ԫ�أ��ش��������⣺��1��M��Ԫ�����ڱ��е�λ��Ϊ�������ڢ�A�壻����Ԫ�ص�ԭ�Ӱ뾶�Ӵ�С��˳����Al��C��N��O��H����Ԫ�ط��ű�ʾ����
��2��Z��X��Ԫ�ذ�ԭ����Ŀ��l��3��2��4���ɷ���A��B��A�ĵ���ʽΪ
 ��B�ĽṹʽΪ
��B�ĽṹʽΪ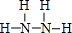 ��
����3������Se��������������Ԫ�أ���Lͬһ���壬Seԭ�ӱ�Lԭ�Ӷ��������Ӳ㣬��Se��ԭ������Ϊ34��
��4��д����X��Z��L����Ԫ����ɵ����ӻ�������ϡNaOH��Һ��Ӧ�����ӷ���ʽ��NH4++OH-=NH3��H2O��
��5��Z2H4��ZO2��һ��˫��ֻ���ƽ������������ʻ�Ϸ�����Ӧ����Z2��X2O��g������֪8g����Z2H4��������Ӧ�зų�142kJ���������Ȼ�ѧ����ʽΪ2N2H4��g��+2NO2��g��=3N2��g��+4H2O��g����H=-1136kJ/mol��
���� M�ǵؿ��к�����ߵĽ���Ԫ�أ�ӦΪAl��X��Y��Z��L����ɵ����ʵĻ���Ԫ�أ���C��N��O��H��P��Ԫ�أ�����X��Y��Z��L��M����Ԫ�ص�ԭ����������������X��Y��Z��L�ֱ�ΪH��C��N��OԪ�أ�
��1��������=���Ӳ���������������=������������
ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶��������Ԫ������ԭ�Ӱ뾶��С��
��2��N��H��Ԫ�ذ�ԭ����Ŀ��l��3�γɵĻ�����AΪNH3��N��H��Ԫ�ذ�ԭ����Ŀ��2��4���ɷ���BΪN2H4������������Nԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ�N2H4������Nԭ��֮���γ�1�Թ��õ��Ӷԣ�Nԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ�
��3�������������������Ԫ������ȷ������ԭ������֮�����Se��ԭ��������
��4����X��Z��L����Ԫ����ɵ����ӻ�����ΪNH4NO3��ϡ��Һ��笠����������������ӷ�Ӧ����һˮ�ϰ���
��5��������Ӧ��2N2H4+2NO2=3N2+4H2O������2molN2H4��Ӧ�ų���������ע�����ʵľۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��
��� �⣺M�ǵؿ��к�����ߵĽ���Ԫ�أ�ӦΪAl��X��Y��Z��L����ɵ����ʵĻ���Ԫ�أ���C��N��O��H��P��Ԫ�أ�����X��Y��Z��L��M����Ԫ�ص�ԭ����������������X��Y��Z��L�ֱ�ΪH��C��N��OԪ�أ�
��1��MΪAl��ԭ�Ӻ�����3�����Ӳ㣬����������Ϊ3���������ڱ��е������ڢ�A�壬
ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶��������Ԫ������ԭ�Ӱ뾶��С����ԭ�Ӱ뾶��Al��C��N��O��H��
�ʴ�Ϊ���������ڢ�A�壻Al��C��N��O��H��
��2��N��H��Ԫ�ذ�ԭ����Ŀ��l��3�γɵĻ�����AΪNH3��N��H��Ԫ�ذ�ԭ����Ŀ��2��4���ɷ���BΪN2H4������������Nԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ������ʽΪ ��N2H4������Nԭ��֮���γ�1�Թ��õ��Ӷԣ�Nԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ���ṹʽΪ
��N2H4������Nԭ��֮���γ�1�Թ��õ��Ӷԣ�Nԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ���ṹʽΪ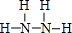 ��
��
�ʴ�Ϊ�� ��
��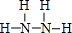 ��
��
��3��Se��Oͬһ���壬Seԭ�ӱ�Oԭ�Ӷ��������Ӳ㣬����������8+18=26����Se��ԭ������Ϊ8+26=34��
�ʴ�Ϊ��34��
��4����X��Z��L����Ԫ����ɵ����ӻ�����ΪNH4NO3��ϡ��Һ��笠����������������ӷ�Ӧ����һˮ�ϰ�����Ӧ���ӷ���ʽΪ��NH4++OH-=NH3��H2O��
�ʴ�Ϊ��NH4++OH-=NH3��H2O��
��5��������Ӧ��2N2H4+2NO2=3N2+4H2O��2molN2H4��Ӧ�ų�������Ϊ142kJ��$\frac{2mol��32g/mol}{8g}$=1136kJ���ʷ�Ӧ�Ȼ�ѧ����ʽΪ��2N2H4��g��+2NO2��g��=3N2��g��+4H2O��g����H=-1136kJ/mol��
�ʴ�Ϊ��2N2H4��g��+2NO2��g��=3N2��g��+4H2O��g����H=-1136kJ/mol��
���� ���⿼��λ�ýṹ�����ʹ�ϵ��Ӧ�ã���Ŀ�Ѷ��еȣ�ע����ݵ����ʵ����Ԫ�ؽ��Ԫ�ص�ԭ��������ϵ�����ƶϣ�����������ѧ�����Ӧ�û���֪ʶ�������������Ȼ�ѧ����ʽ����д��

| A�� | 95g | B�� | 10g | C�� | 50g | D�� | 100g |
| A�� | ����Ͷ�뵽NaOH��Һ�У�2Al+2OH-=2AlO2-+H2�� | |
| B�� | ���ۼ������Ȼ�����Һ�У�2Fe+Fe3+=3Fe2+ | |
| C�� | AlCl3��Һ�м��������ˮ��Al3++4OH-��AlO2-+2H2O | |
| D�� | FeCl2��Һ�м�����ˮ��Cl2+2 Fe2+=2 Fe3++2Cl- |
| A�� | �ⶨ��Һ��pHֵ��Ӧ�Ƚ�pH��ֽ������ˮ��ʪ | |
| B�� | �������Ⱥ�Ĺ���ʱ�������Ƚ������ڿ�������ȴ���ٳ��� | |
| C�� | ����0.1mol/LNa2CO3��Һʱ������ƿӦ����0.1mol/L Na2CO3��ϴ | |
| D�� | ��ȥ�����л��е��������ۣ��ɼ��˹���������������Һ����ȫ��Ӧ����ˡ����� |

| A�� | ����Ϊ������ | B�� | �ҿ���Ϊ���� | ||
| C�� | ������Ϊþ | D�� | ����Ϊ�������� |
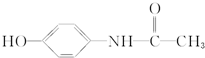 �ٷ����ڷ�ҺΪ������ʹҩ����Ҫ��������ͷʹ�����գ�����Ҫ��ѧ�ɷֵĽṹ��ʽ���£������йظ��л����������ȷ���ǣ�������
�ٷ����ڷ�ҺΪ������ʹҩ����Ҫ��������ͷʹ�����գ�����Ҫ��ѧ�ɷֵĽṹ��ʽ���£������йظ��л����������ȷ���ǣ�������| A�� | ����ʽΪC8H10NO2 | |
| B�� | ���л������ڦ�-������ | |
| C�� | ���л������ڦ�-�������ͬ���칹����3�� | |
| D�� | ���л�����FeCl3��Һ������ɫ��Ӧ |
 ����E����������Ȼ��ﶼ�ܸ����������d
����E����������Ȼ��ﶼ�ܸ����������d