题目内容
4.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | 少量二氧化碳通入NaClO溶液中:2NaClO+CO2+H2O→Na2CO3+2HClO | |
| B. | 过量的 HCN滴入碳酸钠溶液中 HCN+Na2CO3→NaCN+NaHCO3 | |
| C. | 结合质子能力由强到弱的顺序为:HCO3->CN->C6H5O- | |
| D. | 常温下电离常数:Ka2(H2CO3)>Ka(C6H5OH)>Ka (HCN) |
分析 相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,酸的电离平衡常数从小到大顺序是:HCO3-<C6H5OH<HCN<HClO<H2CO3<CH3COOH,据此分析解答.
解答 解:A.酸性HCO3-<HClO,所以少量二氧化碳通入NaClO溶液中发生的反应为:NaClO+CO2+H2O=NaHCO3+HClO,故A错误;
B.酸性HCO3-<HCN<H2CO3,所以过量的HCN滴入碳酸钠溶液中发生反应:HCN+Na2CO3=NaCN+NaHCO3,故B正确;
C.酸根离子水解程度越大,其结合质子能力越强,酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,所以酸根离子结合质子能力大小顺序是CO32->CN->HCO3->CH3COO-,故C错误;
D.酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,酸的电离平衡常数从小到大顺序是:HCO3-<C6H5OH<HCN<HClO<H2CO3<CH3COOH,故D错误;
故选B.
点评 本题考查了盐类水解,明确酸根离子水解程度与酸的电离平衡常数、相同浓度钠盐溶液pH大小的关系是解本题关键,再结合强酸制取弱酸来分析解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.影响化学反应速率的因素很多,下列措施能加快化学反应速率的是( )
| A. | 减小接触面积 | B. | 升高温度 | C. | 减小压强 | D. | 降低反应物浓度 |
2.1mol某烃最多能与1molHCl加成生成氯代烃,1mol该氯代烃能与5molCl2发生取代反应,则该烃为( )
| A. | C2H6 | B. | C2H4 | C. | C3H6 | D. | C6H10 |
12.配合物Na2[Fe(CN)5(NO)]可用于离子检验,此配合物中不存在的化学键是( )
| A. | 离子键 | B. | 金属键 | C. | 氢键 | D. | 极性共价键 |
9.取一小块钠,用滤纸擦去掉煤油,放在坩埚里面加热,下列实验现象的描述正确的是 ( )
①金属钠先熔化
②在空气中燃烧呈苍白色火焰且火花四溅
③燃烧后得到白色固体
④燃烧时有黄色火焰
⑤燃烧后生成淡黄色固体.
①金属钠先熔化
②在空气中燃烧呈苍白色火焰且火花四溅
③燃烧后得到白色固体
④燃烧时有黄色火焰
⑤燃烧后生成淡黄色固体.
| A. | ①②⑤ | B. | ①④⑤ | C. | ①②③ | D. | ①②④ |
13.下列物质长期露置在空气中,因发生氧化还原反应而变质的是( )
| A. | 浓硫酸 | B. | 氢氧化钠 | C. | 硫酸亚铁 | D. | 浓盐酸 |
14.对下图有机物的命名正确的是( )
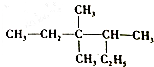

| A. | 2-乙基-3,3-二,甲基戊烷 | |
| B. | 3,3,4-三甲基己烷 | |
| C. | C的价电子轨道表示式:3,3-甲基-4乙基戊烷 | |
| D. | 2,3,3-三甲基己烷 |