题目内容
8.下列反应中生成物总能量高于反应物总能量的是( )| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | ||
| C. | 盐酸与氢氧化钠中和 | D. | 氧化钙溶于水 |
分析 生成物总能量高于反应物总能量的反应属于吸热反应,根据常见的放热反应和吸热反应进行判断.若反应物的总能量大于生成物的总能量则为放热反应.
常见的放热反应有:所有的物质燃烧、所有金属与酸、所有中和反应、绝大多数化合反应,铝热反应;
常见的吸热反应有:个别的化合反应(如C和CO2)、绝大数分解反应、少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:A.碳酸钙受热分解属于吸热反应,生成物总能量高于反应物总能量,故A正确;
B.乙醇燃烧属于放热反应,生成物的总能量小于反应物的总能量,故B错误;
C.盐酸与氢氧化钠中和反应属于放热反应,生成物的总能量小于反应物的总能量,故C错误;
D.氧化钙溶于水与水发生化合反应,属于放热反应,生成物的总能量小于反应物的总能量,故D错误.
故选A.
点评 本题主要考查了放热反应和放热反应,题目难度不大,掌握常见的放热反应和放热反应是解题的关键.

练习册系列答案
相关题目
13.下列物质长期露置在空气中,因发生氧化还原反应而变质的是( )
| A. | 浓硫酸 | B. | 氢氧化钠 | C. | 硫酸亚铁 | D. | 浓盐酸 |
20.下列说法中正确的是( )
| A. | NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28′ | |
| C. | NaCl晶体中与每个Na+距离相等且最近的Na+共有8个 | |
| D. | 区分晶体和非晶体最科学的方法是对固体进行X一射线衍射实验 |
17.对于金属冶炼的工业方法,下列有关说法中正确的是( )
| A. | 可用电解饱和的MgCl2溶液的方法获得金属镁 | |
| B. | 电解CuSO4溶液精炼金属铜时,用铁做阳极 | |
| C. | 电解熔融Al2O3方法冶炼金属铝时,同时要加入冰晶石作助熔剂 | |
| D. | 工业上常采用活泼金属还原法冶炼金属银 |
18.某课外兴趣小组刚收集到一瓶当地的酸雨,计划通过实验检测酸雨的主要成分进而分析探讨当地酸雨的成因.
I.同学们首先对当地酸雨的成因提出假设
假设1.空气中含有的过多的氮氧化物造成的;
假设2.空气中含有的过多的二氧化硫造成的;
假设3.空气中过多的氮氧化物、二氧化硫共同造成的.
一组同学设计实验验证假设1,请在下表空白处填写相关实验现象.
其中涉及的化学反应的离子方程式是Cu+4H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++2NO2↑+2H2O(或3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O).
另一组同学验证假设2,取适量样品并向其中加入盐酸酸化的BaCl2溶液,没有看到白色沉淀生成,该小组得出结论:假设2不成立,你认为是否合理?不合理(填“合理”或“不合理”,如果填“合理”,本小题余下的空不需要填写).如果不合理,请说明原因因为BaCl2与溶液中可能存在的SO32-反应生成的沉淀可溶解于盐酸中.你认为合理的实验验证方案取适量样品,加入适量Ba(OH)2溶液.
I.同学们首先对当地酸雨的成因提出假设
假设1.空气中含有的过多的氮氧化物造成的;
假设2.空气中含有的过多的二氧化硫造成的;
假设3.空气中过多的氮氧化物、二氧化硫共同造成的.
一组同学设计实验验证假设1,请在下表空白处填写相关实验现象.
| 实验步骤 | 实验现象 | 结论 |
| 取适量样品加热浓缩后加入试管中,再加入适量硫酸和铜片,加热. | 假设1成立 |
另一组同学验证假设2,取适量样品并向其中加入盐酸酸化的BaCl2溶液,没有看到白色沉淀生成,该小组得出结论:假设2不成立,你认为是否合理?不合理(填“合理”或“不合理”,如果填“合理”,本小题余下的空不需要填写).如果不合理,请说明原因因为BaCl2与溶液中可能存在的SO32-反应生成的沉淀可溶解于盐酸中.你认为合理的实验验证方案取适量样品,加入适量Ba(OH)2溶液.

 $\stackrel{Br_{2}/P}{→}$
$\stackrel{Br_{2}/P}{→}$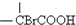
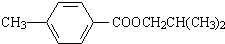 .
.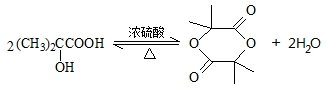 ,该反应属于酯化反应(填反应类型).
,该反应属于酯化反应(填反应类型).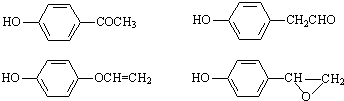 .
. )结构.
)结构.