题目内容
5.在某温度下,一密闭容器中模拟工业合成氨:N2(g)+3H2(g)?2NH3(g)△H<0;反应起始各物质的量如表:| N2 | H2 | NH3 | |
| 起始物质的量(mol) | 2 | 2 | 0 |
| A. | 平衡时NH3的物质的量:0mol<n(NH3)<$\frac{4}{3}$mol | |
| B. | 平衡时,N2的转化率为$\frac{α}{3}$ | |
| C. | 现将容器体积压缩到原来的一半,再次到达平衡之后,N2的体积分数变小 | |
| D. | 其他条件不变,若起始充入 N2、H2、NH3的物质的分别为:1.5mol、0.5mol、1mol,则到达平衡时,NH3的体积分数为x% |
分析 由表中数据可知起始加入2mol氮气,2mol氢气,达到平衡之后的 H2转化率α,NH3的体积分数为x%,则
N2(g)+3H2(g)?2NH3(g)
起始(mol) 2 2 0
转化(mol) $\frac{2α}{3}$ 2α $\frac{4α}{3}$
平衡(mol) 2-$\frac{2α}{3}$ 2-2α $\frac{4α}{3}$
且$\frac{\frac{4α}{3}}{4-\frac{4α}{3}}$=x%,以此解答该题.
解答 解:由表中数据可知起始加入2mol氮气,2mol氢气,达到平衡之后的 H2转化率α,NH3的体积分数为x%,则
N2(g)+3H2(g)?2NH3(g)
起始(mol) 2 2 0
转化(mol) $\frac{2α}{3}$ 2α $\frac{4α}{3}$
平衡(mol) 2-$\frac{2α}{3}$ 2-2α $\frac{4α}{3}$
A.因反应为可逆反应,2mol氢气如完全反应,则理论上生成$\frac{4}{3}$mol氨气,但为可逆反应,则平衡时NH3的物质的量:0mol<n(NH3)<$\frac{4}{3}$mol,故A正确;
B.转化$\frac{2α}{3}$mol氮气,起始为2mol,则转化率为$\frac{α}{3}$,故B正确;
C.现将容器体积压缩到原来的一半,平衡正向移动,气体总物质的量减小,再次到达平衡之后,N2的体积分数可能增大,故C错误;
D.若起始充入 N2、H2、NH3的物质的分别为:1.5mol、0.5mol、1mol,等效于起始加入2mol氮气,2mol氢气,达到相同平衡状态,则NH3的体积分数为x%,故D正确.
故选C.
点评 本题考查化学平衡的计算,为高考常见题型,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率,易错点为C,答题时需注意.

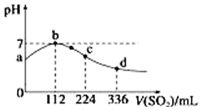 标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )
标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )| A. | b点水的电离程度比c点水的电离程度大 | |
| B. | 氢硫酸的酸性比亚硫酸的酸性强 | |
| C. | 原H2S溶液的物质的量浓度为0.05 mol•L-1 | |
| D. | a点对应溶液的导电性比d点强 |
| A. | Cu(OH)2中加入硫酸:OH-+H+=H2O | |
| B. | 钠加入水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 铁片与氯化铜溶液反应:Fe+Cu2+=Cu+Fe2+ | |
| D. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=H2O+BaSO4↓ |
| A. | 工业合成氨时使用催化剂 | |
| B. | 配制SnCl2溶液时加入一定量的盐酸 | |
| C. | 25℃时,在稀硫酸溶液中由水电离出的c(H+)<1×10-7mol/L | |
| D. | AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
| A. | 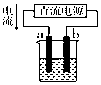 用装置精炼铜,则b极为精铜,电解质溶液为CuSO4溶液 | |
| B. | 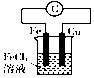 装置的总反应是Cu+2Fe3+=Cu2++2Fe2+ | |
| C. | 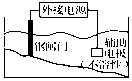 装置中钢闸门应与外接电源的负极相连 | |
| D. | 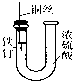 装置中的铁钉浸入浓硫酸中几乎没被腐蚀 |
| 起始加入量(mol) | 平衡时 | ||||
| A | B | C | A或C转化率(%) | C的物质的量分数(%) | 放出或吸收热量(KJ) |
| 1 | 1 | 0 | α1 | φ1 | Q1 |
| 0 | 0 | 2 | α2 | φ2 | Q2 |
| 2 | 2 | 0 | α2 | φ3 | Q3 |
| A. | α1+α2=1;φ2=φ1 | B. | φ3=2φ1;Q3=2Q1 | C. | φ3=φ1=φ2;Q3=2Q1 | D. | α1=α3;Q1+Q2=Q |
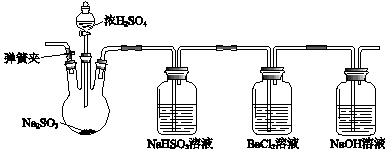
 、NaOH
、NaOH .
.