题目内容
13.实验室制取氯化氢气体,下列可以选用的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A.装置是工业制备氯化氢气体的原理,实验室中是利用固体氯化钠和浓硫酸加热反应;
B.浓硫酸密度大于浓盐酸,浓盐酸滴入会引起液体沸腾;
C.氯化钠固体和硫酸氢钠固体混合加热反应生成氯化氢气体是实验室制备;
D.装置中二氧化锰、氯化钠固体和浓硫酸加热反应生成的主要是氯气.
解答 解:A..装置是工业制备氯化氢气体的原理,实验室中是利用固体氯化钠和浓硫酸加热反应,故A错误;
B.浓硫酸密度大于浓盐酸,浓盐酸滴入会引起液体沸腾,应是浓硫酸滴入浓盐酸得到氯化氢气体,故B错误;
C.氯化钠固体和硫酸氢钠固体混合加热反应生成氯化氢气体是实验室制备,NaHSO4+NaCl$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+HCl↑,故C正确;
D.装置中二氧化锰、氯化钠固体和浓硫酸加热反应生成的主要是氯气,不能制备氯化氢气体,故D错误;
故选C.
点评 本题考查了常见气体的制备装置、制备原理和方法,注意制备装置的实质理解应用和需要注意的问题,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.一定条件下,在体积为10L的恒容密闭容器中,发生如下反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
| A. | 用Y 表示的化学反应速率为0.005 mol/(L•s) | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若升高温度Y的转化率减小,则正反应为放热反应 | |
| D. | 达到平衡时,Y与Z的浓度相等 |
4.下列关于物质性质的比较,不正确的是( )
| A. | 金属性强弱:Na>Mg>Al | B. | 热稳定性:Na2CO3>NaHCO3 | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 酸性强弱:HIO4>HBrO4>HClO4 |
1.某化学实验室产生的废液中含有Fe3+、Cu2+、Zn2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备较纯净的氯化锌、氯化铁晶体.
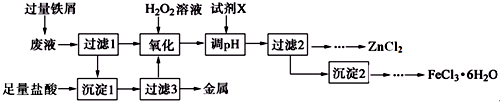
(1)氧化过程中加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,加入H2O2后立即有大量气泡生成,可能的原因是溶液中金属阳离子催化H2O2分解.
(2)Fe3+水解的平衡常数表达式为Kh=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$,加入试剂X调pH合适范围为[3.7,5.4),X可以是下列试剂中的AD(填字母).
A.ZnCO3 B.NH3•H2O C.ZnCl2 D.ZnO
(3)由沉淀2获得FeCl3•6H2O晶体的操作为①加入过量盐酸溶解;②蒸发浓缩、冷却结晶;③过滤、洗涤、干燥.

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 5.2 | 5.4 |
| 完全沉淀pH | 3.7 | 9.6 | 6.9 | 7.8 |
(2)Fe3+水解的平衡常数表达式为Kh=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$,加入试剂X调pH合适范围为[3.7,5.4),X可以是下列试剂中的AD(填字母).
A.ZnCO3 B.NH3•H2O C.ZnCl2 D.ZnO
(3)由沉淀2获得FeCl3•6H2O晶体的操作为①加入过量盐酸溶解;②蒸发浓缩、冷却结晶;③过滤、洗涤、干燥.
18.下列说法正确的是( )
| A. | 室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| B. | 用NaOH溶液可以区分HCOOCH3和HCOOCH2CH3 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均能发生水解反应,且产物相同 |
2.下列有关金属钠的说法不正确的是( )
| A. | 钠具有银白色金属光泽,在空气中易变质,生成过氧化钠 | |
| B. | 钠应保存在煤油中 | |
| C. | 钠的化学性质很活泼,在自然界不能以游离态存在 | |
| D. | 钠和钾的合金在室温呈液态,可做原子反应堆的导热剂 |
3.无色透明溶液中能大量共存的离子组是( )
| A. | Na+、Al3+、HCO3-、NO3- | B. | AlO2-、Cl-、Mg2+、K+ | ||
| C. | NH4+、Na+、CH3COO-、NO3- | D. | Na+、NO3-、Fe3+、I- |
