题目内容
1.某化学实验室产生的废液中含有Fe3+、Cu2+、Zn2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备较纯净的氯化锌、氯化铁晶体.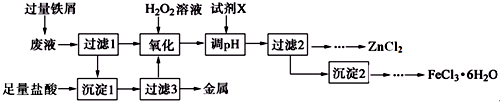
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 5.2 | 5.4 |
| 完全沉淀pH | 3.7 | 9.6 | 6.9 | 7.8 |
(2)Fe3+水解的平衡常数表达式为Kh=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$,加入试剂X调pH合适范围为[3.7,5.4),X可以是下列试剂中的AD(填字母).
A.ZnCO3 B.NH3•H2O C.ZnCl2 D.ZnO
(3)由沉淀2获得FeCl3•6H2O晶体的操作为①加入过量盐酸溶解;②蒸发浓缩、冷却结晶;③过滤、洗涤、干燥.
分析 对废液进行处理,以回收金属并制备较纯净的氯化锌、氯化铁晶体,结合实验流程可知,废液中加Fe,Fe3+、Cu2+均与Fe反应,沉淀1含Fe、Cu,沉淀1与足量盐酸反应得到的金属为Cu,滤液中含Fe2+、Zn2+、Cl-,Fe2+与过氧化氢发生氧化还原反应生成Fe3+,试剂X为ZnO、ZnCO3等促进铁离子水解转化为沉淀,过滤2含Zn2+、Cl-,沉淀2为Fe(OH)3,沉淀2与盐酸反应后,蒸发浓缩、冷却结晶得到晶体,以此来解答.
解答 解:对废液进行处理,以回收金属并制备较纯净的氯化锌、氯化铁晶体,结合实验流程可知,废液中加Fe,Fe3+、Cu2+均与Fe反应,沉淀1含Fe、Cu,沉淀1与足量盐酸反应得到的金属为Cu,滤液中含Fe2+、Zn2+、Cl-,Fe2+与过氧化氢发生氧化还原反应生成Fe3+,试剂X为ZnO、ZnCO3等促进铁离子水解转化为沉淀,过滤2含Zn2+、Cl-,沉淀2为Fe(OH)3,沉淀2与盐酸反应后,蒸发浓缩、冷却结晶得到晶体,
(1)氧化过程中加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,加入H2O2后立即有大量气泡生成,可能的原因是溶液中金属阳离子催化H2O2分解,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;溶液中金属阳离子催化H2O2分解;
(2)由Fe3++3H2O?Fe(OH)3+3H+,可知水解平衡常数Kh=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$,结合表格中的数据可知,试剂X为ZnO、ZnCO3等,调节pH为[3.7,5.4),
故答案为:Kh=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$;[3.7,5.4); AD;
(3)由沉淀2获得FeCl3•6H2O晶体的操作为①加入过量盐酸溶解;②蒸发浓缩、冷却结晶;③过滤、洗涤、干燥,故答案为:蒸发浓缩、冷却结晶.
点评 本题考查物质的制备实验,为高频考点,把握物质的性质、流程中发生的反应、反应原理及混合物分离为解答的关键,侧重分析与实验能力的综合考查,注意盐类水解原理的应用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案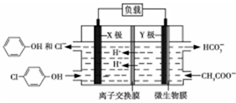 测得某工业废水中含有乙酸钠及对氯酚(
测得某工业废水中含有乙酸钠及对氯酚(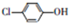 ),为改善水质现利用微生物电池加以去除,反应原理如图所示,下列说法正确的是( )
),为改善水质现利用微生物电池加以去除,反应原理如图所示,下列说法正确的是( )| A. | X极为微生物电池的负极 | |
| B. | 该电池能够在高温下工作 | |
| C. | 图中离子交换膜应为阴离子交换膜 | |
| D. | Y极电极反应式为:CH3COO--8e-+4H2O═2HCO3-+9H+ |

| A. | 甲的溶解度大于乙的溶解度 | |
| B. | t1℃时,甲的溶解度为ag | |
| C. | 升高温度,乙的饱和溶液全变成不饱和溶液 | |
| D. | t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数相等 |
| A. | ${\;}_{92}^{235}$U的中子数为235 | |
| B. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是两种核素,它们互称为同素异形体 | |
| C. | 核反应属于化学变化 | |
| D. | 合理利用核能符合“低碳经济”要求 |
| A. | 用太阳能蒸馏海水是海水淡化的方法之一 | |
| B. | 推广使用无磷洗衣粉主要是为了防止水体富营养化 | |
| C. | 水厂常用硫酸亚铁和氯气处理水,可起到消毒杀菌和除去水中悬浮杂质的作用 | |
| D. | 水在3.98℃时,主要以(H2O)2存在,这两个水分子间是以共价键相结合的 |
| A. |  | B. |  | C. |  | D. |  |


 .(2分)
.(2分)