题目内容
5.分析下列列氧化还原反应,回答有关问题.(1)2KMnO4+10KI+8H2SO4═6K2SO4+2MnSO4+5I2+8H2O
被还原的元素Mn,发生氧化反应的物质KI.
(2)3Cl2+6NaOH═5NaCl+NaClO3+3H2O
氧化剂与还原剂的物质的量之比为5:1.
分析 (1)2KMnO4+10KI+8H2SO4═6K2SO4+2MnSO4+5I2+8H2O中,Mn元素的化合价降低,I元素的化合价升高;
(2)3Cl2+6NaOH═5NaCl+NaClO3+3H2O只有Cl元素的化合价变化,5个Cl得到电子与1个Cl失去电子相同,以此来解答.
解答 解:(1)2KMnO4+10KI+8H2SO4═6K2SO4+2MnSO4+5I2+8H2O中,Mn元素的化合价降低,Mn得到电子被还原,I元素的化合价升高,KI失去电子被氧化,
故答案为:Mn;KI;
(2)3Cl2+6NaOH═5NaCl+NaClO3+3H2O只有Cl元素的化合价变化,5个Cl得到电子与1个Cl失去电子相同,则氧化剂与还原剂的物质的量之比为5:1,
故答案为:5:1.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化及基本概念为解答的关键,侧重分析与应用能力的考查,注意电子守恒的应用,题目难度不大.

练习册系列答案
相关题目
15.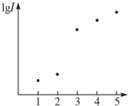 电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )
电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )
 电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )
电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )| A. | 第ⅠA族 | B. | 第ⅡA族 | C. | 第ⅢA族 | D. | 第ⅣA族 |
16.核能是人类最具希望的未来能源,安全、合理地开发利用核能日益受到人们的关注.${\;}_{92}^{235}$U是核反应堆的重要原料,下列说法中正确的是( )
| A. | ${\;}_{92}^{235}$U的中子数为235 | |
| B. | ${\;}_{92}^{235}$U和${\;}_{92}^{238}$U是两种核素,它们互称为同素异形体 | |
| C. | 核反应属于化学变化 | |
| D. | 合理利用核能符合“低碳经济”要求 |
13.实验室制取氯化氢气体,下列可以选用的是( )
| A. |  | B. |  | C. |  | D. |  |
20.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-) | |
| B. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:3(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
17.下列电离方程式的书写错误的是( )
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | MgCl2═Mg2++2Cl- | D. | Ca(OH)2═Ca2++2OH- |
14.已知某离子的结构示意图为 ,x-y<10,该粒子为( )
,x-y<10,该粒子为( )
 ,x-y<10,该粒子为( )
,x-y<10,该粒子为( )| A. | 阴离子 | B. | 原子 | C. | 阳离子 | D. | 原子 |
15.下列说法中,正确的是( )
| A. | 电解质与非电解质本质区别是在水溶液或熔化状态下能否电离 | |
| B. | 纯碱、烧碱均属于碱 | |
| C. | 电离时能产生H+的化合物,一定是酸 | |
| D. | 非金属氧化物一定是酸性氧化物 |
