题目内容
3.一定条件下,在体积为10L的恒容密闭容器中,发生如下反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )| A. | 用Y 表示的化学反应速率为0.005 mol/(L•s) | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若升高温度Y的转化率减小,则正反应为放热反应 | |
| D. | 达到平衡时,Y与Z的浓度相等 |
分析 A.结合v=$\frac{△c}{△t}$及速率之比等于化学计量数之比计算;
B.该反应为气体体积缩小的反应,将容器体积变为20 L,平衡逆向移动;
C.若升高温度Y的转化率减小,可知升高温度,平衡逆向移动;
D.起始浓度未知,不能确定平衡时Y的浓度.
解答 解:A.v(Z)=$\frac{△c}{△t}$=$\frac{\frac{0.3mol}{10L}}{60s}$=0.0005mol/(L•s),由速率之比等于化学计量数之比可知,用Y 表示的化学反应速率为0.0005 mol/(L•s),故A错误;
B.该反应为气体体积缩小的反应,将容器体积变为20 L,平衡逆向移动,则Z的平衡浓度小于原来的$\frac{1}{2}$,故B错误;
C.若升高温度Y的转化率减小,可知升高温度,平衡逆向移动,则正反应为放热反应,故C正确;
D.起始浓度未知,不能确定平衡时Y的浓度,则达到平衡时,不能判断Y与Z的浓度关系,故D错误;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握速率的计算、压强、温度对平衡移动的影响为解答的关键,侧重分析与应用能力的综合考查,注意起始浓度未知,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
4.在反应3Cl2+8NH3=N2+6NH4Cl中,氧化剂与还原剂分子个数之比为( )
| A. | 8:3 | B. | 3:8 | C. | 3:2 | D. | 1:3 |
9.下列实验操作正确的是( )
| A. | 蒸馏过程中发现未加沸石,应立即补加沸石 | |
| B. | 分液过程中先将下次液体分出,稍等片刻后再分出上层液体 | |
| C. | 海水提溴即用有机溶剂中海水中萃取溴 | |
| D. | 除去NaCl少量KNO3,可先配成饱和溶液,然后蒸发结晶、趁热过滤 |
8.在2L的密闭容器中,一定量的A和B发生反应:3A(g)+B(g)?xC(g)+2D(g),经测定5min内C的平均反应速率是0.1mol/(L•min),同时生成1mol D.下列有关说法正确的是( )
| A. | 5min内D的平均反应速率是0.2mol/(L•min) | |
| B. | 3υA=2υD | |
| C. | x的值是2 | |
| D. | A的起始物质的量为1.5mol |
15.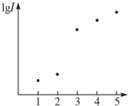 电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )
电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )
 电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )
电离能是指从气态原子在基态时失去电子成为阳离子所吸收的能量,如图表示元素X的前五级电离能的对数值,试推测X可能是哪些元素( )| A. | 第ⅠA族 | B. | 第ⅡA族 | C. | 第ⅢA族 | D. | 第ⅣA族 |
12.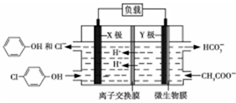 测得某工业废水中含有乙酸钠及对氯酚(
测得某工业废水中含有乙酸钠及对氯酚(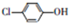 ),为改善水质现利用微生物电池加以去除,反应原理如图所示,下列说法正确的是( )
),为改善水质现利用微生物电池加以去除,反应原理如图所示,下列说法正确的是( )
 测得某工业废水中含有乙酸钠及对氯酚(
测得某工业废水中含有乙酸钠及对氯酚( ),为改善水质现利用微生物电池加以去除,反应原理如图所示,下列说法正确的是( )
),为改善水质现利用微生物电池加以去除,反应原理如图所示,下列说法正确的是( )| A. | X极为微生物电池的负极 | |
| B. | 该电池能够在高温下工作 | |
| C. | 图中离子交换膜应为阴离子交换膜 | |
| D. | Y极电极反应式为:CH3COO--8e-+4H2O═2HCO3-+9H+ |
13.实验室制取氯化氢气体,下列可以选用的是( )
| A. |  | B. |  | C. |  | D. |  |
 2012年世界青年奥运会将在南京举办.保护环境,人人有责.
2012年世界青年奥运会将在南京举办.保护环境,人人有责.