题目内容
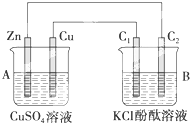 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题:(1)锌极为
(2)石墨棒C1为
(3)当C2极析出224mL气体(标准状况)时,锌的质量
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)左边装置能自发的进行氧化还原反应,所以为原电池,右边装置为电解池;
(2)原电池中锌作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极电极反应式为Cu2++2e-=Cu,石墨棒C1为阳极,电极反应式为2Cl--2e-=Cl2↑,石墨棒C2为阴极,电极反应式为2H++2e-=H2↑,根据溶液中氢离子浓度变化判断pH变化;
(3)根据串联电路中转移电子相等进行计算.
(2)原电池中锌作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极电极反应式为Cu2++2e-=Cu,石墨棒C1为阳极,电极反应式为2Cl--2e-=Cl2↑,石墨棒C2为阴极,电极反应式为2H++2e-=H2↑,根据溶液中氢离子浓度变化判断pH变化;
(3)根据串联电路中转移电子相等进行计算.
解答:
解:(1)左边装置能自发的进行氧化还原反应,能将化学能转化为电能,所以为原电池,右边装置有外接电源,属于电解池,原电池中锌作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极电极反应式为Cu2++2e-=Cu,
故答案为:负;Zn-2e-=Zn2+;正;Cu2++2e-=Cu;
(2)石墨棒C1为阳极,电极反应式为2Cl--2e-=Cl2↑,石墨棒C2为阴极,电极反应式为2H++2e-=H2↑,石墨棒C2附近还生成氢氧根离子,导致溶液碱性增强,则溶液的pH增大,酚酞遇碱变红色,所以石墨棒C2附近发生的实验现象是:有气体生成、溶液变红色,
故答案为:阳; 2Cl--2e-=Cl2;有气体生成,溶液变红;
(3)C2极析出的气体是氢气,氢气的物质的量=
=0.01mol,原电池中锌作负极而被腐蚀,所以随着反应的进行,锌的质量逐渐减少,生成0.01mol氢气转移电子的物质的量=0.01mol×2=0.02mol,根据串联电路中转移电子相等知,锌减少的质量=
×65g/mol=0.65g,在原电池中,锌作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极电极反应式为Cu2++2e-=Cu,转移0.02mol电子,溶解0.65gZn,析出0.64gCu,溶液质量增加0.01g,
故答案为:减少;0.65;增加;0.01.
故答案为:负;Zn-2e-=Zn2+;正;Cu2++2e-=Cu;
(2)石墨棒C1为阳极,电极反应式为2Cl--2e-=Cl2↑,石墨棒C2为阴极,电极反应式为2H++2e-=H2↑,石墨棒C2附近还生成氢氧根离子,导致溶液碱性增强,则溶液的pH增大,酚酞遇碱变红色,所以石墨棒C2附近发生的实验现象是:有气体生成、溶液变红色,
故答案为:阳; 2Cl--2e-=Cl2;有气体生成,溶液变红;
(3)C2极析出的气体是氢气,氢气的物质的量=
| 0.224L |
| 22.4L/mol |
| 0.02mol |
| 2 |
故答案为:减少;0.65;增加;0.01.
点评:本题考查了原电池和电解池原理,根据反应的自发性确定原电池和电解池,再结合各个电极上发生的反应来分析解答,难点是电极反应式的书写,题目难度不大.

练习册系列答案
相关题目
工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+O2
2SO3,这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下述有关说法中错误的是( )
| V2O5 |
| △ |
| A、使用催化剂是为了加快反应速率,提高生产效率 |
| B、在上述条件下,SO2不可能100%地转化为SO3 |
| C、为了提高SO2的转化率,应适当提高O2的浓度 |
| D、达到平衡时,SO2的浓度与SO3的浓度相等 |
下列说法错误的是( )
| A、由电能转化为化学能的装置叫电解池 |
| B、在电解池中跟直流电源的正极相连的电极是电解池的阳极 |
| C、在电解池中通电时,电子从电解池的阴极流出,并沿导线流回电源的负极 |
| D、电解池中阴极发生还原反应,阳极发生氧化反应 |
下列离子方程式表达正确的是( )
| A、碳酸氢钠的水解反应:HCO3-+H2O?CO32-+H+ |
| B、铝片跟氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ |
| C、亚硫酸溶液中通入氧气:2H2SO3+O2═4H++2SO42- |
| D、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- |
下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有( )
| A、SO2、O2、N2 |
| B、HCl、Cl2、CO2 |
| C、CH4、H2、CO |
| D、SO2、Cl2、O2 |
如表为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
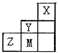

| A、非金属性:Y>Z>M |
| B、原子半径:M>Z>Y |
| C、气态氢化物的稳定性:Y<M<Z |
| D、ZM2分子中各原子的最外层均满足8e-稳定结构 |
下列关于反应能量的说法正确的是( )
| A、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H=-216kJ/mol,E反应物>E生成物 | ||||
| B、CaCO3(s)=CaO(s)+CO2(g);△H=+178.5kJ/mol,E反应物>E生成物 | ||||
C、HI(g)?
| ||||
| D、H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,含1molNaOH水溶液与含0.5mol H2SO4的浓硫酸混合后放热57.3 kJ |