题目内容
下列离子方程式表达正确的是( )
| A、碳酸氢钠的水解反应:HCO3-+H2O?CO32-+H+ |
| B、铝片跟氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ |
| C、亚硫酸溶液中通入氧气:2H2SO3+O2═4H++2SO42- |
| D、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.碳酸氢根离子部分水解生成碳酸和氢氧根离子,该式为电离方程式;
B.该反应中水参加反应,方程式电荷、原子不守恒;
C.亚硫酸和氧气在水溶液中反应生成强酸硫酸;
D.向次氯酸钠溶液中通入足量SO2气体,+4价硫被氧化成+6价.
B.该反应中水参加反应,方程式电荷、原子不守恒;
C.亚硫酸和氧气在水溶液中反应生成强酸硫酸;
D.向次氯酸钠溶液中通入足量SO2气体,+4价硫被氧化成+6价.
解答:
解:A.HCO3-+H2O?CO32-+H+为碳酸氢钠电离方程式,碳酸氢钠电离出的碳酸氢根离子部分水解生成碳酸和氢氧根离子,其水解的离子方程式为HCO3-+H2O?H2CO3+OH-,故A错误;
B.该反应中水参加反应,离子方程式为2H2O+2Al+2OH-=2AlO2-+3H2↑,故B错误;
C.亚硫酸具有还原性,被氧气氧化成强酸硫酸2H2SO3+O2═4H++2SO42-,故C正确;
D.次氯酸钠具有强氧化性,氧化SO2气体:ClO-+SO2+H2O═Cl-+SO42-+2H+,故D错误;
故选C.
B.该反应中水参加反应,离子方程式为2H2O+2Al+2OH-=2AlO2-+3H2↑,故B错误;
C.亚硫酸具有还原性,被氧气氧化成强酸硫酸2H2SO3+O2═4H++2SO42-,故C正确;
D.次氯酸钠具有强氧化性,氧化SO2气体:ClO-+SO2+H2O═Cl-+SO42-+2H+,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,熟悉发生的反应即可解答,注意离子反应中的电荷守恒及电子守恒来解答,题目难度不大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
下列各组溶液不加任何试剂,只需要用试管和滴管两两互滴就能鉴别的是( )
| A、盐酸、氢氧化钠、氯化钠 |
| B、氢氧化钠、氢氧化钡、硫酸 |
| C、硫酸氢钠、碳酸钠、氢氧化钠 |
| D、硫酸铜、盐酸、硫酸 |
可逆反应mA(气)+nB?pC(气)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )
| A、增大压强,平衡不移动,说明(m+n)一定等于(p+q) |
| B、升高温度,A的转化率减小,说明正反应是吸热反应 |
| C、若增加B的量,平衡体系颜色加深,说明B必是气体物质 |
| D、若B是气体,增加A的量,A、B转化率都一定增大 |
下列实验操作中错误的是( )
| A、进行蒸发操作时,应加热至混合物中有大量晶体析出时停止加热,用余热蒸干 |
| B、进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
近几年冬天,全国多个地区发生持续大雾天气;从2012年开始,我国多地开始“PM2.5”数据监测.“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可吸入肺颗粒物.下列有关说法中,错误的是 ( )
| A、雾属于胶体,能产生丁达尔效应 |
| B、持续大雾天气给农业生产、交通运输等带来很大影响 |
| C、大雾的形成与汽车的尾气排放有很大关系 |
| D、“PM2.5”悬浮在空气中形成胶体,严重危害人体健康 |
下列关于晶体的说法一定正确的是( )
| A、分子晶体中都存在共价键 |
| B、金属晶体的熔点都比分子晶体的熔点高 |
| C、SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
D、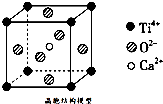 某物质晶胞结构如图,该物质的化学式为CaTiO3(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点) |
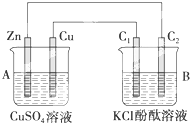 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题: