题目内容
按要求完成以下内容:
(1)Fe2(SO4)3水溶液呈 性,原因是(用离子方程式表示): ;实验室在配制Fe2(SO4)3溶液时,需要加入 来抑制水解.
(2)有三瓶pH均为2的盐酸、硫酸溶液、醋酸溶液.
①设三种溶液的物质的量浓度依次为c1、c2、c3,则它们之间由小到大的顺序为 (用“>”“<”或“=”表示,下同).
②取同体积的三种酸溶液,分别加入足量锌,反应开始产生H2的速率依次为v1、v2、v3,则它们之间的关系是 ;
(3)某温度下,水的离子积常数KW=10-14.该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为 .
(1)Fe2(SO4)3水溶液呈
(2)有三瓶pH均为2的盐酸、硫酸溶液、醋酸溶液.
①设三种溶液的物质的量浓度依次为c1、c2、c3,则它们之间由小到大的顺序为
②取同体积的三种酸溶液,分别加入足量锌,反应开始产生H2的速率依次为v1、v2、v3,则它们之间的关系是
(3)某温度下,水的离子积常数KW=10-14.该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为
考点:电解质与非电解质,pH的简单计算,离子浓度大小的比较
专题:
分析:(1)硫酸铁是强酸弱碱盐,铁离子水解导致溶液呈酸性,要抑制铁离子水解,可以向溶液中加入少量酸;
(2)①醋酸是一元弱酸、氯化氢是一元强酸,硫酸是二元强酸,pH相等的三种酸溶液中,醋酸浓度最大;
②反应速率与氢离子浓度成正比;
(3)pH=9的NaOH溶液中氢氧根离子的物质的量浓度=
=10-5 mol/L,pH=4的H2SO4溶液中氢离子的物质的量浓度=10-4 mol/L,水的离子积常数Kw=10-14,即pH=7时,溶液呈中性.
(2)①醋酸是一元弱酸、氯化氢是一元强酸,硫酸是二元强酸,pH相等的三种酸溶液中,醋酸浓度最大;
②反应速率与氢离子浓度成正比;
(3)pH=9的NaOH溶液中氢氧根离子的物质的量浓度=
| 10-14 |
| 10-9 |
解答:
解:(1)硫酸铁是强酸弱碱盐,铁离子水解导致溶液呈酸性,水解方程式为Fe3++3H2O?Fe(OH)3+3H+,要抑制铁离子水解且不引进新的杂质离子,可以向溶液中加入少量稀硫酸,
故答案为:酸;Fe3++3H2O?Fe(OH)3+3H+;稀硫酸;
(2)①醋酸是一元弱酸、氯化氢是一元强酸,硫酸是二元强酸,pH相等的三种酸溶液中,醋酸浓度最大,这三种酸的浓度关系为:c3>c1>c2,
故答案为:c2<c1<c3;
②反应速率与氢离子浓度成正比,反应开始时,三种酸中氢离子浓度相等,所以反应速率相等,即v1=v2=v3,故答案为:v1=v2=v3;
(3)pH=9的NaOH溶液中氢氧根离子的物质的量浓度=
=10-5 mol/L,pH=4的H2SO4溶液中氢离子的物质的量浓度=10-4 mol/L,水的离子积常数Kw=10-14,即PH=7时,溶液呈中性,设稀硫酸的体积为V1,氢氧化钠的体积为V2,即此时有n(H+)=n(OH-)=V1×10-4=10-5×V2,故
=
=1:10,故答案为:1:10.
故答案为:酸;Fe3++3H2O?Fe(OH)3+3H+;稀硫酸;
(2)①醋酸是一元弱酸、氯化氢是一元强酸,硫酸是二元强酸,pH相等的三种酸溶液中,醋酸浓度最大,这三种酸的浓度关系为:c3>c1>c2,
故答案为:c2<c1<c3;
②反应速率与氢离子浓度成正比,反应开始时,三种酸中氢离子浓度相等,所以反应速率相等,即v1=v2=v3,故答案为:v1=v2=v3;
(3)pH=9的NaOH溶液中氢氧根离子的物质的量浓度=
| 10-14 |
| 10-9 |
| V1 |
| V2 |
| 10-5 |
| 10-4 |
点评:本题考查了盐类水解的应用、混合溶液pH的计算等,熟练掌握水的离子积是解决本题关键,难度不大.

练习册系列答案
相关题目
海水是镁的主要来源之一,从海水中提取镁可按如下步骤进行:①把贝壳煅烧成石灰;②在引有海水的渠中加入石灰,经过沉淀,然后过滤得到沉淀物;③就沉淀物与盐酸反应,然后结晶、过滤、干燥得MgCl2?6H2O晶体;④在一定条件下将MgCl2?6H2O晶体加热生成无水氯化镁;⑤电解熔融的氯化镁获得单质镁.根据上述提取镁的全过程,没有涉及的反应类型是( )
| A、分解反应 | B、化合反应 |
| C、置换反应 | D、氧化还原反应 |
可逆反应mA(气)+nB?pC(气)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )
| A、增大压强,平衡不移动,说明(m+n)一定等于(p+q) |
| B、升高温度,A的转化率减小,说明正反应是吸热反应 |
| C、若增加B的量,平衡体系颜色加深,说明B必是气体物质 |
| D、若B是气体,增加A的量,A、B转化率都一定增大 |
下列关于电解质的叙述正确的是( )
| A、CaCO3在水中溶解度很小,所以CaCO3是弱电解质 |
| B、若某种电解质溶液中含有未电离的分子,则该电解质一定是弱电解质 |
| C、氯气和氨气的水溶液导电性都很好,所以它们是电解质 |
| D、SO3的水溶液可以导电,但它不是电解质 |
下列实验操作中错误的是( )
| A、进行蒸发操作时,应加热至混合物中有大量晶体析出时停止加热,用余热蒸干 |
| B、进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、2.8g乙烯中含有共价键的数目为0.5NA |
| C、标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
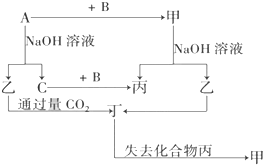 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图示的转换关系,已知C为密度最小的气体,甲是电解质.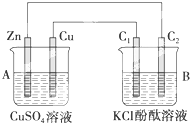 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题: