题目内容
(1)写出下图中序号①~④仪器的名称:
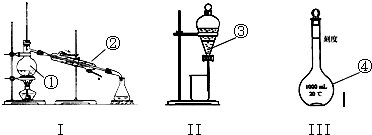
① ;② ; ③ ;④ ;
(2)仪器①~④中,使用前必须检漏的 .(填仪器序号)
(3)分离碘水中的碘应在 (填装置序号)进行 和 操作.
(4)现欲用98%的浓硫酸(密度为1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸100mL.
①所需仪器除烧杯、玻璃棒外还需 、 、 .
②所取浓硫酸的体积为 mL.
③下列操作引起所配溶液浓度偏高的是
A.用量筒取浓硫酸时俯视
B.将浓硫酸倒出后,洗涤量筒,并将洗涤液倒入烧杯中
C.在烧杯中稀释浓硫酸后,立即转移
D.定容时仰视
E.颠倒摇匀后发现液面低于刻度线,但未加水至刻度线
④本实验最费时间的是将稀释后的硫酸冷却至室温,为节省时间,简单易行的加快稀硫酸冷却的方法是 .
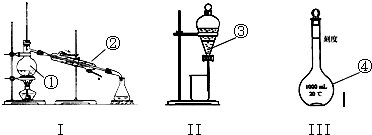
①
(2)仪器①~④中,使用前必须检漏的
(3)分离碘水中的碘应在
(4)现欲用98%的浓硫酸(密度为1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸100mL.
①所需仪器除烧杯、玻璃棒外还需
②所取浓硫酸的体积为
③下列操作引起所配溶液浓度偏高的是
A.用量筒取浓硫酸时俯视
B.将浓硫酸倒出后,洗涤量筒,并将洗涤液倒入烧杯中
C.在烧杯中稀释浓硫酸后,立即转移
D.定容时仰视
E.颠倒摇匀后发现液面低于刻度线,但未加水至刻度线
④本实验最费时间的是将稀释后的硫酸冷却至室温,为节省时间,简单易行的加快稀硫酸冷却的方法是
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据仪器的构造来分析;
(2)本身带有塞子或活塞的仪器使用前必须查漏;
(3)碘的分离和提纯应该用萃取和分液的方法;
(4)①根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
②先计算出浓硫酸的物质的量浓度为c=
,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;
③根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
④把烧杯放入盛有冷水的水槽中可使溶液快速冷却.
(2)本身带有塞子或活塞的仪器使用前必须查漏;
(3)碘的分离和提纯应该用萃取和分液的方法;
(4)①根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
②先计算出浓硫酸的物质的量浓度为c=
| 1000ρω |
| M |
③根据c=
| n |
| V |
④把烧杯放入盛有冷水的水槽中可使溶液快速冷却.
解答:
解:(1)由仪器的构造可知,①是蒸馏烧瓶,②是冷凝管,③是分液漏斗,④是容量瓶,故答案为:蒸馏烧瓶,冷凝管,分液漏斗,容量瓶;
(2)本身带有塞子或活塞的仪器使用前必须查漏,故使用前必须查漏的仪器是③④,故答案为:③④;
(3)碘的分离和提纯应该用萃取和分液的方法,故在装置II中进行,故答案为:II,萃取,分液;
(4)
①根据操作步骤有计算、量取、稀释、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管.故答案为:量筒、100mL容量瓶、胶头滴管;
②浓硫酸的物质的量浓度为c=
=
=18.4mol/L,设所取浓硫酸的体积为XmL,根据溶液稀释定律C浓V浓=C稀V稀可知:
18.4mol/L×XmL=0.5mol/L×100mL
解得V=2.7mL,故答案为:2.7;
③A.用量筒取浓硫酸时俯视,会导致所取的浓硫酸的体积偏小,则配制出的溶液的浓度偏低,故A不选;
B.将浓硫酸倒出后,洗涤量筒的洗涤液应注入废液缸,如果将洗涤液倒入烧杯中则会导致溶质偏多,浓度偏高,故B选;
C.稀释浓硫酸时放热,若稀释后未冷却就立即转移并定容,则冷却后溶液体积偏小,故浓度偏高,故C选;
D.定容时仰视,会导致溶液体积偏大,则浓度偏小,故D不选;
E.颠倒摇匀后发现液面低于刻度线是正常的,未加水至刻度线是正确的,对浓度无影响,故E不选;
故选BC;
④烧杯放入盛有冷水的水槽中可使溶液快速冷却,故答案为:冷水浴.
(2)本身带有塞子或活塞的仪器使用前必须查漏,故使用前必须查漏的仪器是③④,故答案为:③④;
(3)碘的分离和提纯应该用萃取和分液的方法,故在装置II中进行,故答案为:II,萃取,分液;
(4)
①根据操作步骤有计算、量取、稀释、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管.故答案为:量筒、100mL容量瓶、胶头滴管;
②浓硫酸的物质的量浓度为c=
| 1000ρω |
| M |
| 1000×1.84g/ml×98% |
| 98g/mol |
18.4mol/L×XmL=0.5mol/L×100mL
解得V=2.7mL,故答案为:2.7;
③A.用量筒取浓硫酸时俯视,会导致所取的浓硫酸的体积偏小,则配制出的溶液的浓度偏低,故A不选;
B.将浓硫酸倒出后,洗涤量筒的洗涤液应注入废液缸,如果将洗涤液倒入烧杯中则会导致溶质偏多,浓度偏高,故B选;
C.稀释浓硫酸时放热,若稀释后未冷却就立即转移并定容,则冷却后溶液体积偏小,故浓度偏高,故C选;
D.定容时仰视,会导致溶液体积偏大,则浓度偏小,故D不选;
E.颠倒摇匀后发现液面低于刻度线是正常的,未加水至刻度线是正确的,对浓度无影响,故E不选;
故选BC;
④烧杯放入盛有冷水的水槽中可使溶液快速冷却,故答案为:冷水浴.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案
相关题目
分离下列三组混合物依次采取的方法正确的是:①氯化钠溶液和鸡蛋清 ②植物油和氯化钠溶液 ③碳酸钙和氯化钙的溶液( )
| A、渗析、蒸馏、萃取 |
| B、渗析、分液、过滤 |
| C、分液、过滤、加热升华 |
| D、蒸馏、萃取、分液 |
下列各组溶液不加任何试剂,只需要用试管和滴管两两互滴就能鉴别的是( )
| A、盐酸、氢氧化钠、氯化钠 |
| B、氢氧化钠、氢氧化钡、硫酸 |
| C、硫酸氢钠、碳酸钠、氢氧化钠 |
| D、硫酸铜、盐酸、硫酸 |
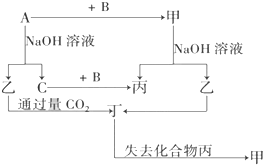 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图示的转换关系,已知C为密度最小的气体,甲是电解质. Ⅰ、阅读、分析下列两个材料:
Ⅰ、阅读、分析下列两个材料: 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题: