题目内容
如表为短周期的一部分,推断关于Y、Z、M的说法正确的是( )
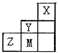

| A、非金属性:Y>Z>M |
| B、原子半径:M>Z>Y |
| C、气态氢化物的稳定性:Y<M<Z |
| D、ZM2分子中各原子的最外层均满足8e-稳定结构 |
考点:原子结构与元素周期律的关系
专题:
分析:由元素在短周期的位置可知,X为He,Y为氟,M为Cl,Z为硫.
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
C.非金属性越强,氢化物越稳定;
D.化合价绝对值与原子最外层电子数之和为8,满足8电子稳定结构.
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
C.非金属性越强,氢化物越稳定;
D.化合价绝对值与原子最外层电子数之和为8,满足8电子稳定结构.
解答:
解:由元素在短周期的位置可知,X为He,Y为氟,M为Cl,Z为硫.
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性F>Cl>S,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:S>Cl>F,故B错误;
C.非金属性F>Cl>S,非金属性越强,氢化物越稳定,故C错误;
D.SCl2分子中各元素化合价绝对值与原子最外层电子数之和均为8,满足8电子稳定结构,故D正确,
故选D.
A.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性F>Cl>S,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:S>Cl>F,故B错误;
C.非金属性F>Cl>S,非金属性越强,氢化物越稳定,故C错误;
D.SCl2分子中各元素化合价绝对值与原子最外层电子数之和均为8,满足8电子稳定结构,故D正确,
故选D.
点评:本题考查结构性质位置关系应用,侧重对元素周期律的考查,注意对基础知识的理解掌握.

练习册系列答案
相关题目
海水是镁的主要来源之一,从海水中提取镁可按如下步骤进行:①把贝壳煅烧成石灰;②在引有海水的渠中加入石灰,经过沉淀,然后过滤得到沉淀物;③就沉淀物与盐酸反应,然后结晶、过滤、干燥得MgCl2?6H2O晶体;④在一定条件下将MgCl2?6H2O晶体加热生成无水氯化镁;⑤电解熔融的氯化镁获得单质镁.根据上述提取镁的全过程,没有涉及的反应类型是( )
| A、分解反应 | B、化合反应 |
| C、置换反应 | D、氧化还原反应 |
已知元素X、Y的核电荷数分别是a、b,它们的离子Xm+、Yn-的核外电子排布相同,则下列关系式正确的是( )
| A、a=b+m+n |
| B、a=b-m+n |
| C、a=b+m-n |
| D、a=b-m-n |
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+2CO2↑+K2SO4+2H2O.下列说法正确的是( )
| ||
| A、H2SO4是氧化剂 |
| B、ClO2是氧化产物 |
| C、H2C2O4在反应中被氧化 |
| D、1 molKClO3参加反应有2mol电子转移 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、2.8g乙烯中含有共价键的数目为0.5NA |
| C、标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
05L 1mol/L的FeCl3与0.2L 1mol/L的KCl 溶液中,Cl-的物质的量浓度之比为( )
| A、5:2 | B、1:1 |
| C、3:1 | D、1:3 |
 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题: