题目内容
4.下列图象正确的是( )| A. | 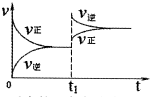 反应的正方向放热(t1时升温) | |
| B. | 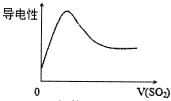 SO2气体通入氯水中 | |
| C. | 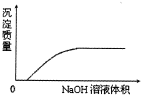 NaOH溶液滴加Ca(HCO3)2溶液中 | |
| D. | 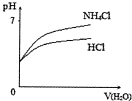 将PH相同的NH4Cl溶液和稀盐酸稀释时PH的变化 |
分析 A.升高温度向吸热方向移动;
B.SO2气体通入氯水中生成硫酸和盐酸,溶液中带电离子浓度增大;
C.NaOH溶液滴加Ca(HCO3)2溶液中生成CaCO3沉淀;
D.加水稀释促进NH4Cl的水解.
解答 解:A.升高温度向吸热方向移动,图中升高温度向逆方向移动,则逆方向为吸热方向,所以反应的正方向放热,故A正确;
B.SO2气体通入氯水中生成硫酸和盐酸,溶液中带电离子浓度增大,所以溶液的导电性增强,当二氧化硫与氯气完全反应时,溶液导电性增强,再通二氧化硫,导电性几乎不变,导电性不会减弱,故B错误;
C.NaOH溶液滴加Ca(HCO3)2溶液中生成CaCO3沉淀,反应一开始就有沉淀产生,故C错误;
D.加水稀释促进NH4Cl的水解,溶液中氢离子的物质的量增大,pH变化小,所以将PH相同的NH4Cl溶液和稀盐酸稀释时,pH变化小的为NH4Cl,故D错误.
故选A.
点评 本题考查了温度对化学平衡的影响、溶液导电性、盐的水解和溶液pH变化等,题目难度中等,侧重于考查学生的分析能力和对图象的把握能力.

练习册系列答案
相关题目
14.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能大于O原子 | N原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为120° |
| C | H2O的沸点大于H2S的沸点 | H2O是液态的,H2S是气态的 |
| D | HF比HCl稳定 | HF分子间可以形成氢键 |
| A. | A | B. | B | C. | C | D. | D |
19.短周期主族元素A、B、C、D的原子序数依次增大,A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍.下列说法正确的是( )
| A. | 原子半径:B>A,离子半径:C<D | |
| B. | B的单质能与A的最高价氧化物发生置换反应 | |
| C. | 元素B和D能形成BD2型的共价化合物 | |
| D. | D的单质有毒,且有漂白性 |
9.由于地球引力的存在,人在地球上生活而不能自动脱离地球.同理,原子之间能自动结合是因为它们之间存在着强烈的相互作用--化学键,由于有化学键才使得100多种元素构成了世界万物.下列有关化学键的叙述,正确的是( )
| A. | 离子化合物中一定含有离子键,可能含共价键,共价化合物中只含共价键绝不含有离子键 | |
| B. | 单质分子中均存在化学键,且只含有共价键,不可能含有离子键 | |
| C. | 共价化合物中可能含非极性共价键,离子化物中不可能含非极性共价键 | |
| D. | 共价化合物中可能含离子键,离子化合物中只含离子键 |
16.根据有机化合物的命名原则,下列命名正确的是( )
| A. | 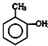 甲基苯酚 甲基苯酚 | |
| B. | 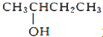 2-羟基丁烷 2-羟基丁烷 | |
| C. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| D. | CH2=CH-CH=CH-CH=CH2 1,3,5-己三烯 |
14.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol,Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为566 kJ/mol | |
| B. | 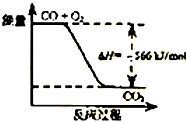 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为4NA |
 ;
; .
. ;
; .
. →
→ ;
; .
.